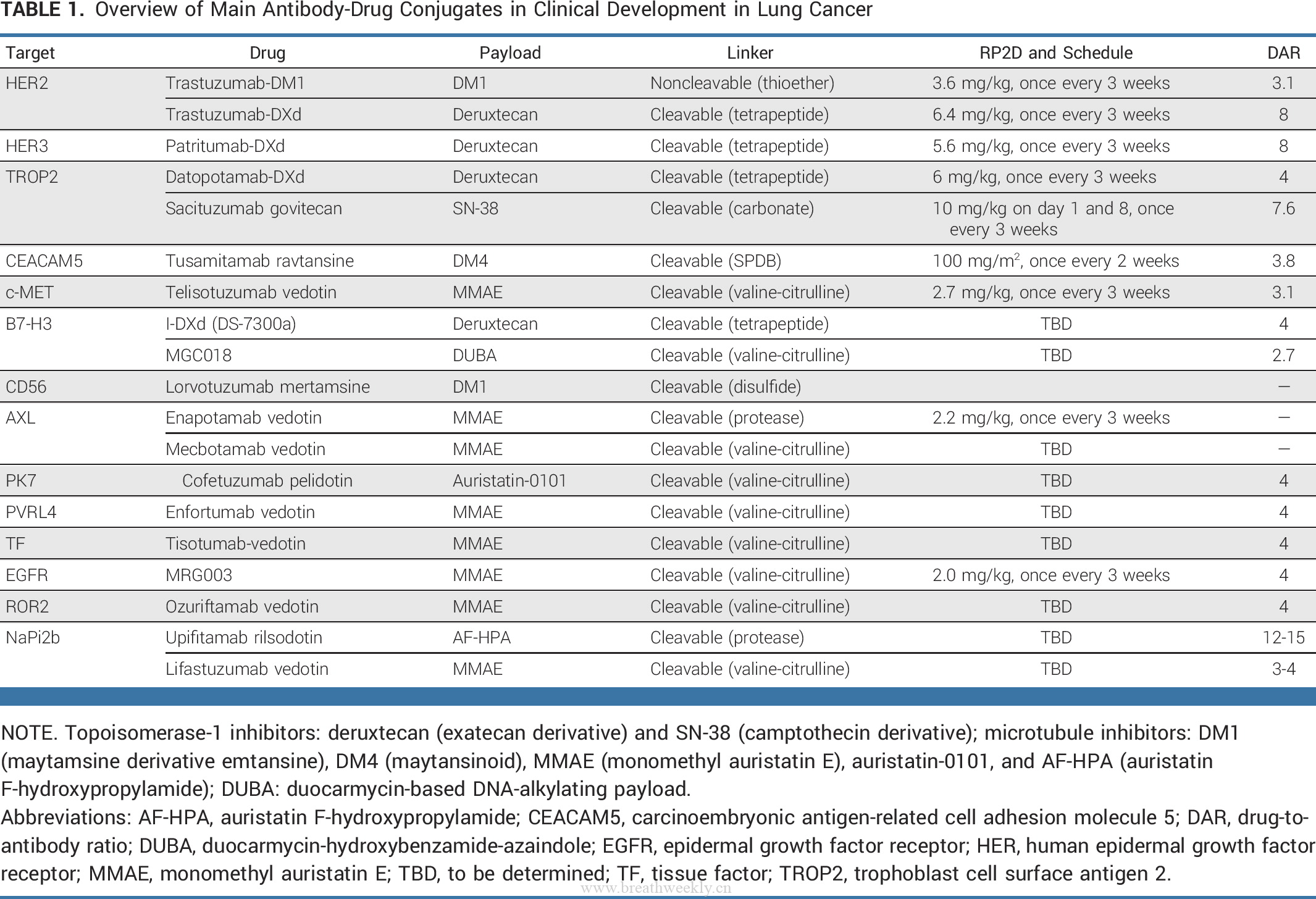
HER3
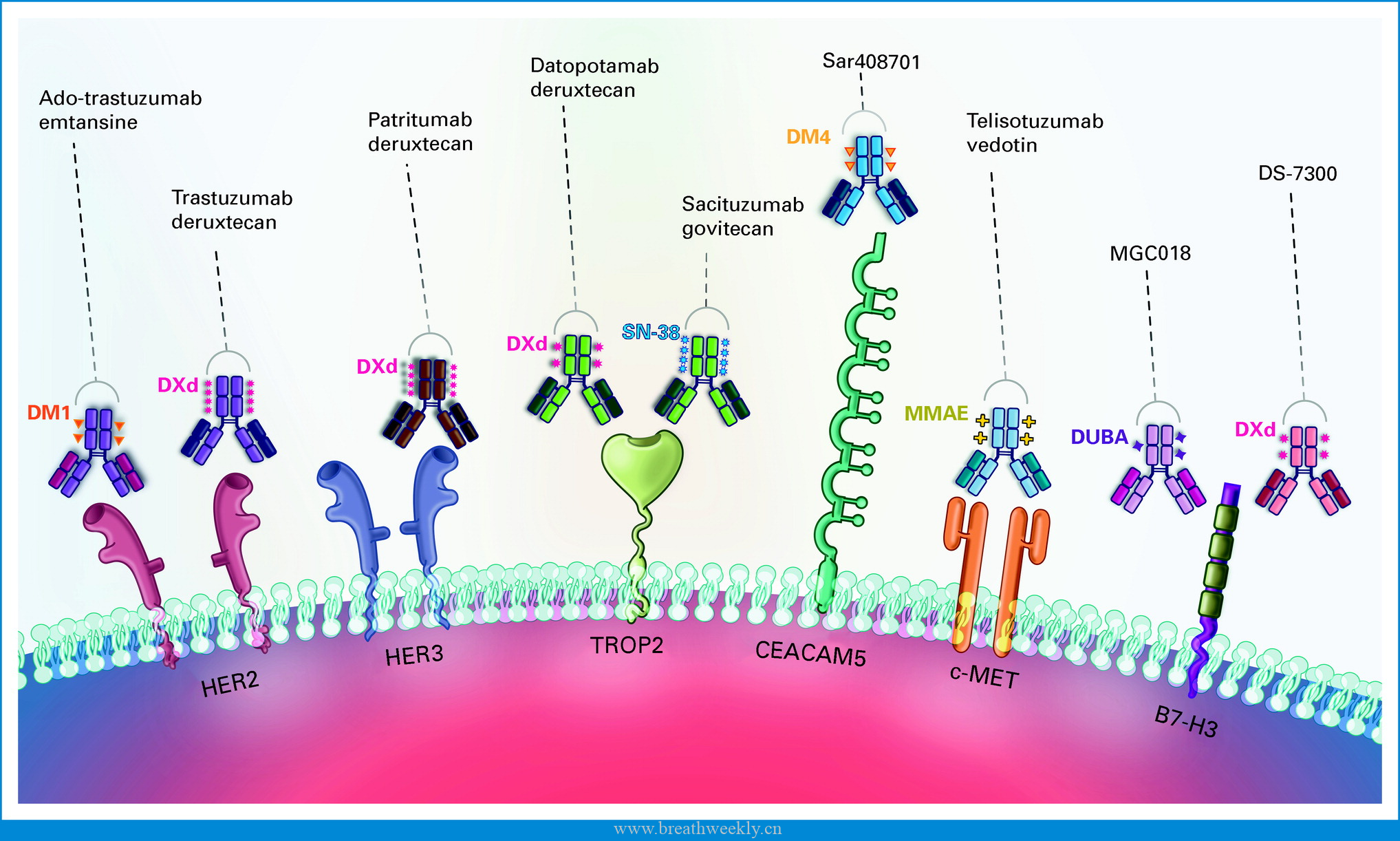
HER3 是 RTKs HER 家族的另一个成员,通常在 NSCLC 中表达 (高达 83%)。据报道,EGFR:HER3 异二聚化是通过增强 ERBB3 依赖性致癌信号传导的激活而成为对 EGFR 酪氨酸激酶抑制剂 (TKI) 耐药的一种机制。Patritumab deruxtecan 是一种靶向 HER3 的 ADC,由全人源化抗HER3 IgG1单克隆抗体通过可裂解四肽连接子与拓扑异构酶I抑制剂有效载荷(一种依喜替康衍生物,DXd)连接组成(图 1;DAR 8)。在 I 期剂量扩展研究 HERTHENA-Lung01 中,57 例 EGFR 突变腺癌患者在既往 EGFR TKI 和队列 1 中的一种或多种既往铂类化疗方案中进展,接受 patritumab deruxtecan 5.6 mg/kg,每 3 周一次。确认的 ORR 为 39%,并且观察到对多种耐药机制具有疗效。在所有患者中观察到 HER3 膜表达,并且在广泛的基线肿瘤 HER3 膜 H 评分中观察到 ORR。DCR 为 72%,mPFS 为 8.2 个月 (95% CI,4.4 至 8.3)。在 54% 的患者中观察到 ≥3 级治疗相关不良反应。在以推荐剂量进行扩展治疗的患者中,有 7% 的患者发生与治疗相关的 ILD。在剂量扩展队列 2 中,包括 47 例既往接受过治疗的未经选择的 NSCLC 患者 (无 EGFR 激活突变)。ORR 为 28%,mPFS 为 5.4 个月 (95% CI,3.9 至 12.7)。Patritumab-DXd 已获得 FDA 的突破性药物资格认定。
滋养层细胞表面抗原-2(TROP2)
滋养层细胞表面抗原 2 (TROP2) 是上皮细胞粘附分子 (EpCAM) 家族的跨膜糖蛋白,经常在许多肿瘤中表达,但在正常组织中低表达。
Datopotamab deruxtecan (Dapo-DXd 德达博妥单抗) 是一种 ADC,由抗 TROP2 单克隆抗体和具有基于四肽的可切割连接子的 DXd 有效载荷组成(图 1;DAR 4)。首次人体 TROPION-PanTumor01 研究包括 175 名既往接受过治疗的 NSCLC 患者,这些患者未区分TROP2 表达,在剂量扩展队列中接受 4、6 或 8 mg/kg 剂量的 Dato-DXd,每 3 周一次。ORR 为 23% 、 21% 和 25%,mPFS 分别为 4.3 、8.2 和 5.4 个月。值得注意的是,在具有可靶向基因组改变的患者 (AGA,n = 34,85% 具有 EGFR 突变) 的亚群分析中观察到活性,显示 ORR 为 35%,中位缓解持续时间 (mDOR) 为 9.5 个月。整个研究人群中的 TEAE 主要是剂量依赖性的,在 8 mg/kg 剂量下,15% 的患者出现 ILD,而在 4 mg/kg 剂量下2%出现 ILD。在可靶向基因组改变人群中,在 38% 的患者中观察到药物相关的 ≥3 级 TEAE,并且只有一例判定为 ILD (5 级) 发生在接受 Dato-DXd 8 mg/kg 的患者中。
然后选择 6 mg/kg 剂量用于正在进行的注册性 III 期随机试验 TROPION-Lung01,评估 Dato-DXd 与多西他赛在既往治疗过的有或没有靶向基因组改变的 NSCLC 中的疗效。正在进行组合 Ib 期研究,以评估 Dato-DXd 与 PD-L1 抑制剂的安全性和有效性。TROPION-Lung02 的初步结果已经公布,评估了 Dato-DXd 与单独 pembrolizumab (双药)或铂类化疗 (三药) 的组合。值得注意的是,假定 ADC 替代铂类化疗,组合臂仅设计了卡铂或顺铂。总体而言,安全性结果可控,口腔炎和恶心是最常见的 TEAE,多为 1-2 级。在一线治疗中,双联和三联队列的 ORR 分别为 62% 和 35%。值得注意的是,Dato-DXd 试验中的患者不是通过肿瘤组织上的 TROP2 表达来选择的,尽管计划进一步进行回顾性评估以评估表达是否与临床疗效相关。
Sacituzumab govitecan 是另一种靶向 TROP2 的 ADC,由抗 TROP2 单克隆抗体、拓扑异构酶 I 抑制剂、伊立替康活性代谢物SN-38 和可切割连接子组成(图 1;DAR 7.6)。
I/II 期 IMMU-132-01 试验共包括 495 名难治性转移性癌症患者,他们在第 1 天和第 8 天接受剂量为 8、10 或 12 mg/kg 的 sacituzumab govitecan,周期为 3 周。在 54 例 NSCLC 患者中,ORR 为 16.7%,mPFS 为 4.4 个月,mOS 为 7.3 个月。值得注意的是,本研究中超过 90% 的可评估肿瘤标本具有高 TROP2 IHC 表达。Sacituzumab govitecan 目前正在评估与多西他赛的比较的 NSCLC 的 III 期试验,以及包括免疫检查点抑制剂和 PARP 抑制剂在内的组合方法(ClinicalTrials.gov 标识符:NCT04826341)。在同一项 IMMU-132-01 研究中,小细胞肺癌患者 (SCLC;n = 62) 的 ORR 为 17.7%,mPFS 为 3.7 个月,mOS 为 7.1 个月。
MET
跨膜RTK c-MET在与肝细胞生长因子结合后被激活,在多种癌症类型中失调。在 NSCLC 中,在 30%-50% 的病例中观察到 MET 过表达,而 MET 扩增 (1.5%) 或 MET 外显子 14 跳跃突变 (3%) 被确定为主要驱动改变——这些分子特征未被发现相关。此外,MET 扩增可作为 EGFR 突变型 NSCLC 的耐药机制发生,对 EGFR TKI 耐药。在现有文献中,采用了 MET 扩增的可变分子定义,影响了试验之间的一致性和可比性。
Telisotuzumab vedotin (Teliso-V) 是一种 ADC,由ABT-700(c-Met靶向)抗体通过可裂解的缬氨酸-瓜氨酸(vc)连接子与细胞毒性微管抑制剂MMAE结合而成(图 1;DAR 3.1)。
Teliso-V 以 2.4-3 mg/kg 每 3 周一次进行的首次人体试验在 16 名 NSCLC 和 MET 过表达患者进行。ORR 为 19%,mPFS 为 5.7 个月,17% 的患者出现 ≥3 级 TEAE。在 II 期试验 Lung-MAP 子研究 S1400K 中,包括 23 例 MET 阳性鳞状 NSCLC 患者,以 2.7 mg/kg 的推荐剂量每 3 周一次治疗,ORR 为 9%。
在一项 Ib 期研究中,Teliso-V 与厄洛替尼联合治疗 c-MET 阳性 NSCLC 患者进行了评估。在 EGFR 突变 (del19 或 L858R) 阳性且对 EGFR TKI 耐药的患者中 (n = 28),ORR 为 32.1%,DCR 为 85.7%,mPFS 为 5.9 个月。在那些 c-MET 表达高的 EGFR 突变阳性患者 (n = 15) 中,ORR 为 52.6%。与既往接受奥希替尼治疗的患者相比,既往未接受过第三代 EGFR TKI 治疗的患者的 ORR (39%) 和 DCR (100%) 更高 (ORR 27% 和 DCR 73.3%)。相反,EGFR WT 患者的 ORR 为 40%,DCR 为 80% (n = 5)。
进行 Luminosity 试验以评估 Teliso-V 治疗的 c-MET 潜在预测生物标志物。在非鳞状 EGFR WT 亚组中,c-MET 高的 ORR 为 53.8%,c-MET 中等的 ORR 为 25% (c-Met 过表达高:≥50% 的肿瘤细胞在 3+ 强度下;中等:25%-49%)。该队列目前正在扩展到第 2 期阶段注册。在非鳞状 EGFR 突变型 (ORR 13.3%) 和鳞状细胞型 (ORR 14.3%) 队列中,结果不太一致。
Teliso-V 和奥希替尼的组合已在 25 例 EGFR 突变肿瘤 NSCLC 患者中进行了评估,这些患者对奥希替尼产生耐药性,并且 c-Met 过表达为高/中度,ORR 为 58%,≥3 级 AE 为 20%。
肺癌 ADC 开发的其他靶点
靶向其他跨膜蛋白或膜受体的不同 ADC,包括癌胚抗原相关细胞粘附分子 5 (CEACAM5)、B7H3 和 δ 样蛋白 3 (DLL3),目前正在肺癌的特定临床试验中开发(表 2)。







暂无评论内容