简介
抗体偶联药物(adc)是一种新型的治疗药物,由单克隆抗体(mAb)通过连接体携带细胞毒性药物(有效载荷)组成。越来越多的抗癌药物被开发出来,通过选择性地递送到表达单克隆抗体靶抗原的肿瘤细胞,从而限制潜在的脱靶全身毒性,从而改善传统化疗的治疗窗口。目前,经评估的 ADC 携带高效的细胞毒性有效载荷,而这些有效载荷由于全身毒性高和治疗指数低,不适合全身使用。因此,有效载荷的短半衰期可以防止潜在的脱靶毒性。连接子(linker)在血浆中必须高度稳定,以防止有效载荷在血液中循环时以非特异性方式释放,同时它们必须在肿瘤部位实现有效的释放。对于每种 ADC,药物抗体比 (DAR) 对应于与每种单克隆抗体相关的有效载荷部分的中位数(在当前已获批准的 ADC 中范围为 2 至 8),预计将反映药物效力和更高的细胞毒性 (表 1)。然而,尽管具有较高 DAR 的 ADC 具有更有效的体外活性,但体内模型显示肝血浆清除速度更快,可能与化合物的整体大小有关,使它们更容易被肝脏清除。因此,肝脏清除率增加可能导致肿瘤对药物的暴露量降低,并可能降低治疗指数。
![图片[1]-肺癌中的抗体偶联药物:最新进展和实施策略ADC(上) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2024/11/1731036899-image.png)
ADC 的作用机制
ADC 活性的第一个要求是足够的肿瘤渗透。事实上,ADC 能够在注射外渗后通过被动扩散到达靶癌细胞,但 mAb 是大分子(约 150 kDa),并且在肿瘤脉管系统中被动扩散的能力可能有限,尤其是在间质压高的肿瘤中。这种机制意味着只有一小部分给药的 ADC 剂量实际上结合肿瘤细胞,通常在小鼠模型中给药后 1-2 天在肿瘤部位的药物浓度达到药理学峰值。
第二个关键步骤包括靶标结合,即 ADC 通过特异性 单克隆抗体与细胞表面的靶抗原结合。该步骤还可能通过阻断配体结合、干扰靶蛋白二聚化、有利于靶蛋白内化和降解或通过 Fc 介导的抗体依赖性细胞毒性 (ADCC) 产生特异性抗体介导的免疫活性。此外,对于致癌信号通路上游的一些靶标(例如,人表皮生长因子受体 2 [HER2]),抗体可能会利用内在活性,特别是通过调节下游信号转导。使用具有致癌功能的 Ab 靶点有利于靶点-ADC 复合物的内化和泛素化,从而降低了作为抗药性机制的靶点表达下调的可能性。
靶标结合后,ADC 抗原复合物通过抗原依赖性内吞作用和内体和/或溶酶体运输而被内化。有效载荷释放发生在初级内体(质膜内陷后立即形成并以低 pH 值为特征的内体)中,以及具有酸裂解的连接子,次级内体(由初级内体成熟形成,以较高的 pH 值为特征)或溶酶体,对于具有蛋白酶可切割接头的内体以及蛋白水解降解后不可切割的接头。此外,由于存在低 pH 值和高浓度蛋白酶的氧化还原肿瘤微环境 (TME),可裂解连接子可以在肿瘤组织内细胞外释放其有效载荷。与内化和加工后穿过细胞膜的有效载荷被动扩散一起,TME 中的有效载荷释放导致了所谓的旁观者效应,即独立于靶抗原表达施加在邻近细胞上的细胞毒作用。然而,并非所有 ADC 都表现出旁观者效应。更高的 DAR 和具有可裂解连接子的 ADC 将支持更高的旁观者效应,而 TME 的特性将调节连接子的可裂解性和有效载荷的释放。最后,肿瘤细胞必须对 ADC 内的细胞毒性有效载荷敏感。
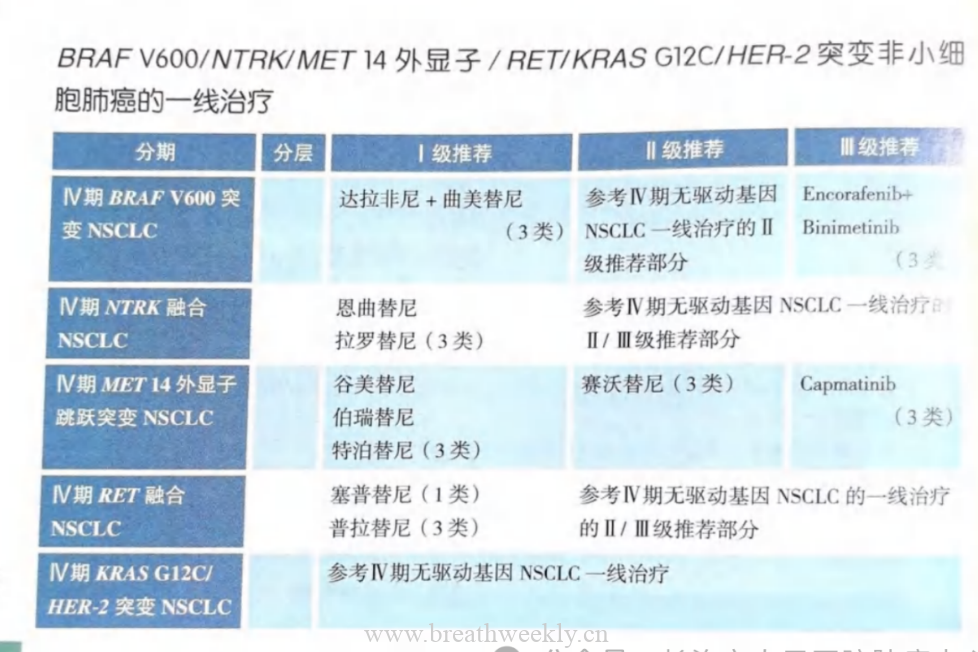
肺癌中 ADC 的主要靶标
HER2 系列
HER2 是一种受体酪氨酸激酶 (RTK),被认为是非小细胞肺癌 (NSCLC) 的治疗靶点。事实上,相应癌基因 ERBB2 的改变可能导致基因扩增(定义为 HER2/CEP7 比值 ≥2,发生在大约 2%-5% 的病例中)、基因突变 (2%-4%) 或蛋白质过表达。HER2 突变包括分布在细胞外结构域、酪氨酸激酶或跨膜结构域中的异质性改变。所有突变的主要形式是外显子 20 插入,最常见的变体是在激酶结构域内的框架中编码 YVMA 的 12 个碱基对。由于 HER2 没有特异性配体,因此下游信号转导通过与 HER1 和人表皮生长因子受体 3 (HER3) 形成同型二聚体和异二聚体来实现。由于 HER2 比其他表现出较高受体转换率的 HER 家族成员更不易内化和降解,因此它可以在细胞膜上长时间保持激活状态,并且代表了 ADC 开发的理论理想靶标。
恩美曲妥珠单抗 (T-DM1) 是一种 ADC,通过不可裂解的硫醚连接子将抗 HER2 单克隆抗体曲妥珠单抗与微管抑制剂美坦新衍生物 (DM1) 偶联(图 1;DAR 3.1)。在一项 II 期篮式研究试验中,18 例 HER2 突变晚期 NSCLC 患者(初治或化疗经治)接受了 T-DM1,总缓解率 (ORR) 为 44%,中位无进展生存期 (mPFS) 为 5 个月。在该试验中未观察到 HER2 免疫组化 (IHC) 表达的预测价值。更新的结果,另外 31 名患者 (HER2 突变或扩增) 入组,显示 ORR 为 51%,mPFS 为 5 个月。另一项 II 期研究在预先治疗的 HER2 过表达 NSCLC 中特异性评估了 T-DM1,反应有限 (ORR 20%),仅限于 IHC3+ 队列 (n = 20)。在 T-DM1 治疗后肿瘤细胞中表皮生长因子受体 (EGFR) 上调的证据后,在奥希替尼治疗后进展后 HER2 过表达和/或扩增的 EGFR 突变患者 (n = 27) 进行了一项 II 期试验 (TRAEMOS),由于在预先计划的中期分析中显示的非常有限的疗效(ORR为13%,mPFS为2.8个月)而提前停止。
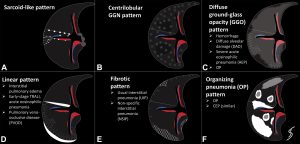
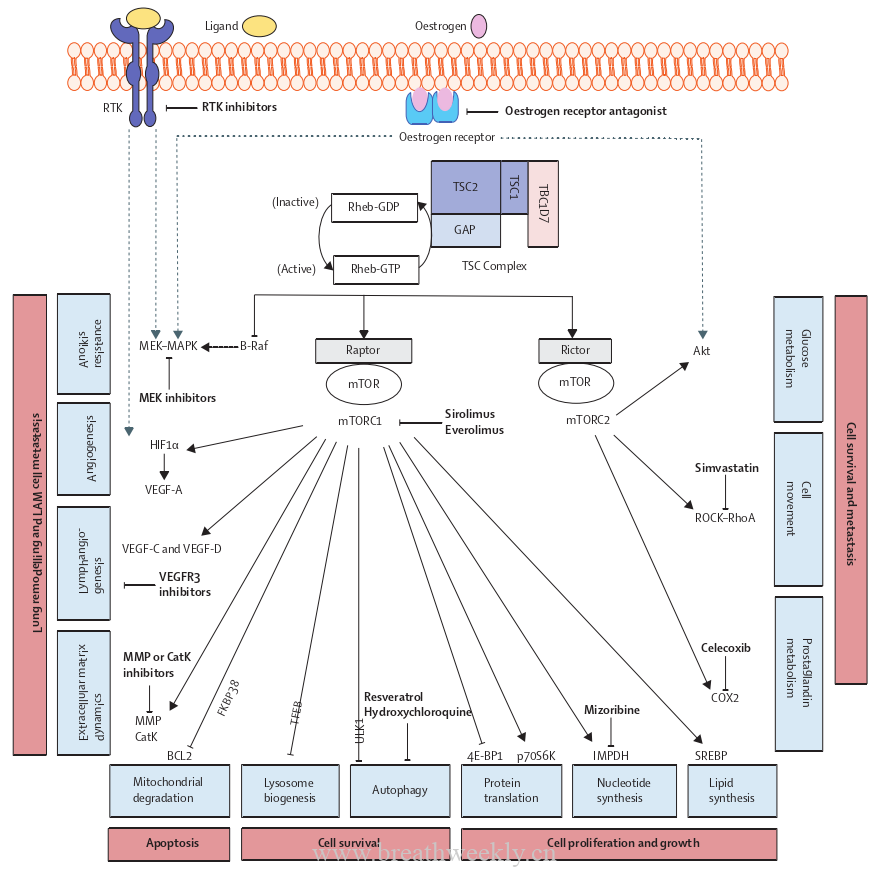
![图片[2]-肺癌中的抗体偶联药物:最新进展和实施策略ADC(上) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2024/11/1731047502-image.png)
图 1.肺癌 ADC 概述。图中报道了用于肺癌治疗的主要 ADC。对于每个 ADC 分子,都表示相应的有效载荷和细胞表面抗原。
德曲妥珠单抗 是另一种 HER2 靶向的 ADC,该单抗通过可切割的连接体(DAR为8)与依沙替康衍生物拓扑异构酶 I 抑制剂耦合 (DXd;图1)。T-DXd 获得美国食品药品监督管理局 (FDA) 的加速批准,用于治疗既往接受过全身治疗的 HER2 突变 NSCLC。该批准基于 II 期 DESTINY-Lung01 试验的结果,该试验包括两组患者:HER2 过表达和 HER2 突变晚期 NSCLC。HER2 突变队列中的 91 例患者接受 T-DXd 6.4 mg/kg,每 3 周一次,ORR 为 55%,疾病控制率 (DCR) 为 92%,mPFS 为 8.2 个月 (95% CI,6.0 至 11.9),中位总生存期 (mOS) 为 17.8 个月。在不同的HER2突变亚型或表达水平或是否存在HER2扩增的情况下,均观察到应答。在HER2突变的非小细胞肺癌中,不管其表达如何,其疗效的一个潜在原因是在存在突变的情况下,HER2内化增强。46% 的患者发生 ≥3 级药物相关不良事件,最常见的是中性粒细胞减少和贫血。值得注意的是,药物相关性间质性肺病 (ILD) 发生在 26% 的患者中。II 期 DESTINY-Lung02 试验将 HER2 突变型 NSCLC 患者随机分配接受 T-DXd 5.4 或 6.4 mg/kg,每 3 周一次。两个队列之间的结果一致,与 6.4 mg/kg 相比,5.4 的安全性更有利 (药物相关 ILD 分别为 5.9% 和 14.0%)。评估 5.4 mg/kg T-DXd 在一线环境中的使用(DESTINY-Lung04)以及与 PD-L1 抑制剂联合使用临床试验正在进行中(表 2)
![图片[3]-肺癌中的抗体偶联药物:最新进展和实施策略ADC(上) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2024/11/1731048650-image.png)
待续。。。
翻译自Passaro A, Jänne PA, Peters S. Antibody-Drug Conjugates in Lung Cancer: Recent Advances and Implementing Strategies. J Clin Oncol. 2023 Jul 20;41(21):3747-3761. doi: 10.1200/JCO.23.00013. Epub 2023 May 24. PMID: 37224424.(需要阅读原文,请于每周呼吸公众号后台回复ADC综述)






暂无评论内容