每周呼吸小程序/网站相关病例:病例50、病例24、病例11。
引言
在间质性肺炎中,机化性肺炎(OP)模式(OPP)是指组织学中发现的息肉样疏松结缔组织阻塞远端气道,大多数是肺泡和肺泡管少数为细支气管。作为一种临床疾病,Davison在1983首次描述了隐源性机化性肺炎(COP),随后Epler等人在1985年定义了闭塞性细支气管炎伴机化性肺炎(BOOP)。并且都强调了特发性和对激素敏感的特点。2002年,ATS/ERS建议使用COP而不是BOOP,并且在2013年更新时仍保持了这一命名方法。COP是指在特发性间质性肺炎中病因不明的一种疾病。相反,继发性机化性肺炎(SOP)是病因明确的OP。OP是少见病,回顾性研究发现,OP的发病率在10万分之1.97-7.这篇文章的目的是对OP的病理和放射特点做一全面回顾,提供了一种为内科医生诊断这种疾病及其亚型的方法。
临床表现
OP没有特异性的临床特点。因此,该病的诊断常会延误6-10周。干咳、流感样表现和劳力性呼吸困难是常见的症状,据报道,OP的症状还包括发热、疲劳和体重减轻。咯血极其罕见。很少发生症状快速进展,呼吸急促恶化而需要机械通气的情况,而且没有临床特征有助于区分COP和SOP(表1)。尽管一项研究的结果表明,SOP更易合并发热而COP症状持续时间较长,但其他研究的结果没有显示出类似的关联。影像学上局灶性OP(FOP)患者通常没有症状。无性别偏好,中位数好发年龄在50-60岁左右。OP在非吸烟者中更为常见。
体检结果通常包括吸气相湿啰音,但在25%的患者中可能是正常的。无杵状指。结缔组织病与SOP相关,因此对结缔组织疾病的相关症状和体征的检查时极为重要的。OP无特异的标志物。白细胞升高可见于50%的病例,全身炎症标志物如C反应蛋白和血沉通常升高。肺功能检查可表现为弥散功能降低。然而,吸烟者可见到阻塞性通气功能障碍。这些检查也可能是正常的,尤其是在一些局灶性OP(FOP)患者。
表1 OP的不同表现
| 类型 | 临床特点 | |
| COP | 类似流感的疾病,咳嗽,呼吸短促,体重减轻,出汗,发冷,发烧,肌痛 | |
| SOP | 同COP | |
| FOP | 通常没有症状,但其他症状包括咳嗽,呼吸短促,胸痛 |
在一些病例中诊断OP需要病理确认。另一些患者中,基于临床和放射学特点,可以考虑观察或经验性治疗(见诊断流程图1)。尽管需要外科手术活检来诊断大多数ILDs。支气管肺泡灌洗和经支气管肺活检(TBBXs)是有效的。在大多数病例中也可考虑为首选的诊断方法。影像鉴别诊断包括出血、感染、恶性肿瘤。支气管肺泡灌洗和TBBXs可以进一步排除上述这些病变。在OP中,BAL通常表现为淋巴细胞、中性粒细胞和嗜酸性粒细胞增多的混合形态。偶尔通过TBBX方法获得的样本可能不足以作出明确的诊断,因此需要进行外科肺活检。或者在某些情况下,如果临床影像高度提示OP,则活检可能被认为是不必要的。如果有的话,由放射科医生、病理学家和呼吸科医生参与的多学科讨论将是至关重要的。这样的讨论可能有助于决定对患者最好的诊断方法。一旦确诊了OP,就应该对OP的次要原因进行详细的调查。
![图片[1]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/1665408313-绘图2.jpg)
图1 OP的诊断流程 并不是所有的病例都需要正式的多学科会诊,特别是如果结合临床背景和影像学模式足以令人信服的OP诊断。
推荐糖皮质激素治疗OP。虽然治疗的持续时间还没有确定,但通常建议以0.5- 1.5 mg/kg开始,然后在6-12个月的时间内逐渐停用。大环内酯类药物可能有助于一些患者作为轻症的唯一治疗或作为皮质类固醇的过渡治疗。通常可以看到皮质类固醇治疗的良好反应。然而,约20%的患者出现不良反应或治疗失败,可能需要修改治疗方案,包括采用其他免疫抑制疗法,如环磷酰胺、硫唑嘌呤、麦考酚酯或利妥昔单抗。复发率较高,从13%到58%,通常在治疗中断或药物减量过程中,特别是如果类固醇突然减少。然而,复发通常与不良结果无关。鉴于OP的炎症性质,炎症标志物如C反应蛋白水平和血沉可能有助于预测复发和对治疗的反应。
影像表现
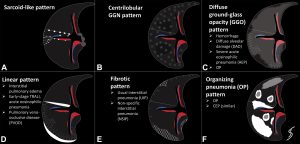
在许多研究中(几乎都是回顾性的和小型的)研究人员描述了OP的影像学表现。尽管所有文献都记录了OP在CT扫描时的显著异质性,但COP和SOP的成像模式没有实质性的差异,在影像学特征的标准化分类方面没有完全达成共识。基于我们的目的,我们采取了以下机化性肺炎分类方法(表格2)。
表2 胸片和CT的OP影像学表现主要鉴别诊断
| 实变为主 | |
| 外周分布 | 慢性嗜酸粒细胞性肺炎、感染(如COVID-19)、出血、梗死、血管炎、误吸、放射性肺炎、药物毒性、电子烟(EVALI)、腺癌、原发性肺淋巴瘤 |
| 支气管血管束 | 单发与多中心腺癌、原发性肺淋巴瘤、结节病、血管炎、CVD(尤其是多发性肌炎或皮肌炎)、卡波西肉瘤、慢性嗜酸性粒细胞性肺炎、肉芽肿性多血管炎 |
| GGO/铺路征 | 急性:感染,出血,水肿,药物中毒 |
| 慢性:肺泡蛋白沉积症,感染,外源性脂质性肺炎,药物毒性(如呋喃妥因),粘液腺癌 | |
| 结节为主型 | |
| 单发 | 支气管肺癌、感染(肉芽肿)、转移性疾病 |
| 多发 | 转移性疾病,多中心腺癌,结节病,侵袭性真菌疾病 |
| 线性或网状为主 | |
| 胸膜下,基底网伴或不伴牵拉性支气管扩张 | NSIP, UIP or IPF |
| 条带 | 石棉肺,ARDS的瘢痕,感染(如副球孢子菌病),肺不张 |
| 小叶周围增厚 | UIP或IPF、出血、非典型肺炎、慢性嗜酸性粒细胞性肺炎、淋巴增生性疾病 |
| 反晕征 | 肉芽肿性多血管炎、结节病、类脂性肺炎、原位腺癌、感染(COVID-19、侵袭性真菌病)、梗死、放射性肺炎、药物毒性 |
以实变为主的OP影像特点
实变是OP病例中最常见的发现,发生在近75%的病例中,病变通常在双基底、支气管血管周围和/或外周(图2,3)。实变可以发生在肺的任何部位,边界清晰或模糊,呈游走性的特点(图4,5),可以呈局灶性,多发性和弥漫性,也可以表现为结节或肿块(图6)。实变常伴支气管充气征,可伴散在的磨玻璃样低密度或小实质结节。以主要的或完全的磨玻璃低密度为表现的较少见(图7)。磨玻璃低密度合并小叶间隔增厚可表现为铺路征(图8)。
![图片[2]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/72753.png)
图2 外周实变。2例患者CT轴位平扫图像。A,这张图片显示了一名女性右肺上叶周围实变,她曾因乳腺癌接受过放射治疗,并经活检证实为机化性肺炎(OP)。B,此图像显示左肺下叶和舌叶周围实变,活检证实为继发于淋巴瘤化疗的OP。
![图片[3]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/72754.png)
图3 支气管血管束分布 在活检证实的机化性肺炎患者中,通过中(A)和下(B)肺区的轴位增强CT扫描图像显示双侧多灶性支气管血管周围实变灶。
![图片[4]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/72755.png)
图4 OP游走性。A, 71岁男性,2011年7月因劳力性呼吸困难就诊,胸片显示右肺上叶实变。B, 2012年6月再次检查显示右肺上叶异常已消失,左肺出现广泛实变。C, 2013年6月,左肺病变消失,但右肺下叶出现新的实变。这些发现是典型的OP的游走性表现。
![图片[5]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/72756.png)
图5 - A-C,机化性肺炎的游走性CT表现。该患者与图4中的患者相同。
![图片[6]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/72757.png)
图6 多灶性、支气管血管周围肿块样实变。患者为70岁女性,确诊COVID-19 9个月后出现持续气促,CT轴位平扫图像显示支气管血管周围多灶性肿块样实变。在类固醇治疗后症状显著改善和实变消退,推测诊断为机化性肺炎。
![图片[7]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/72758.png)
图7 A-C,磨玻璃影(GGO)A,一名有甲状腺乳头状癌病史的47岁男性,碘131治疗4个月后的轴位CT平扫图像,显示右肺上叶支气管血管周围的GGO。PET/CT扫描显示GGO代谢增高(B),轴位CT平扫图像显示左肺上叶新出现的较小GGO区域活动减弱(C)。经支气管活检结果与机化性肺炎相符。
![图片[8]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/72759.png)
图8 铺路征。一名71岁男性因使用胺碘酮导致继发性机化性肺炎的轴位(A)和冠状位(B) CT平扫左肺广泛磨玻璃影,小叶间隔增厚和小叶间隔增厚(铺路石)。
以结节为主的OP影像特点
范围从小的微结节(<4mm)(图9)到较大的离散结节(通常达1cm),以及较大的结节或肿块(图10)。后者常被描述为具有不规则或锐利边缘,通常包含支气管充气征(图11)。结节可以单发或多发,通常为实性结节或部分实性结节(图12)。虽然PET扫描对这些病变的评估显示标准化摄取值轻微升高,但结果是非特异性的,临床价值有限(图13、14)。不常见的OP类型为小结节型,包括弥漫性小叶中心型模糊结节(如在非纤维性过敏性肺炎[HP]病例中可见)和树芽征,提示细支气管感染和/或炎症。
![图片[9]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727510.png)
图9 微小结节。同一患者的高分辨率CT轴位扫描切面(A)和最大密度投影图像(B)。CT扫描图像显示双肺多发小实性结节,提示可能的恶性肿瘤或感染。CT扫描引导下的针吸活检结果与机化性肺炎的诊断一致。
![图片[10]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727511.png)
图10 肿块42岁的患者,病态肥胖,有呼吸困难,右肺上叶(A)和右肺下叶(B)的轴位CT平扫图像显示双侧,胸膜下或周围肿块样实变区域。这些发现是非特异性的;活检结果提示机化性肺炎,类固醇治疗后消退。
![图片[11]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727512.png)
图11 支气管充气征。一名接受美沙拉嗪治疗的38岁男性溃疡性结肠炎患者出现气促。A,后外侧胸片显示双肺多发结节。胸部CT轴位(B)和冠状位(C)增强扫描显示结节周围和支气管血管周围,一些伴有气道扩张(B和C中的箭头)。粗针穿刺活检结果与机化性肺炎相符。
![图片[12]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727513.png)
图12 孤立性结节。一名73岁男性吸烟者低剂量CT。轴位(A)和矢状位(B)平扫图像显示右肺上叶孤立的不规则结节影,伴有细微的气道扩张(箭头在A)。支气管内超声引导下细针活检结果符合局灶性机化性肺炎。
![图片[13]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727514.png)
图13 PET扫描一名无症状、有乳腺癌病史并长期使用呋喃妥因的70岁女性。CT平扫图像显示双肺下叶不规则、实性结节。C,由于担心转移性疾病,进行了PET扫描,轴位PET图像显示左肺下叶(LLL)结节(B和C中的箭头)是FDG高摄取。LLL结节的粗针穿刺活检结果与机化性肺炎相符。
![图片[14]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727515.png)
图14 PET扫描患者女,34岁,因系统性红斑狼疮就诊,表现为气促。A下叶轴位平扫胸部CT显示双肺多发大小不等的实性结节,包括左肺基底部的微小结节改变。B, FDG-PET扫描的冠状位图像显示结节是高代谢的。两个结节的楔形活检结果符合机化性肺炎。
以线状或网状为主的OP影像特点
这种类型包括表现为线状不透明的实质条带,通常延伸到胸膜表面,通常先于磨玻璃样或实变(图15)。其他表现包括小叶周围增厚和具有反晕外观特征的病变(图16)。这个标志,也被称为“环礁征”,其特征是中央磨玻璃不透明(GGO)和外围实变。这些成像模式有着惊人相似的特征,通常可以在相同的情况下识别,甚至在同一张图像上。OP和慢性嗜酸性粒细胞性肺炎之间有相当多的共通之处,特别是当病变主要分布在上叶时。
![图片[15]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727516.png)
图15条带活检证实为机化性肺炎的同一患者,间隔1年进行的轴位CT平扫(A)和增强(B)扫描显示,双肺下叶条带部分消退(A和B的箭头)。
![图片[16]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727517.png)
图16 环礁征或反晕征。一名慢性持续性咳嗽和劳力性呼吸困难1年、体重减轻的32岁男性的CT扫描图像轴位(A)和冠状位(B)图像显示双侧中心磨玻璃样病灶完全被周围致密实变所包围,即反晕征或环礁征(A和B中红色箭头)。也存在不完全晕征(A和B中白色箭头)和小叶周围增厚(B中黄色箭头)。肺活检结果证实为机化性肺炎。
当以线性或网状为主的OP进一步发展,在周围实变或GGO后,基底和胸膜下网状形成,提示间质纤维化的发展(图17)。尽管蜂窝状和结构扭曲的发展可能表明纤维化的进展,OP也可在UIP或IPF中看到,使最终诊断复杂化。此外,OP可导致广泛的双基底牵引性支气管扩张,与背侧胸膜下肺区相对保留相关,其结果与非特异性间质性肺炎(NSIP)相似,并经常重叠(图18,图19)。
![图片[17]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727518.png)
图17 间质纤维化。一名73岁男性在呼吸困难发作4天后获得的轴位CT扫描图像分别在隆突水平(A)和(C)以及肺基底水平(B)和(D)获得胸部CT扫描图像。上一排2019年的增强图像(A和B)显示双侧广泛的磨玻璃影(GGO)。2021年的图像(C和D)显示GGO程度改善,但出现网状和牵拉性支气管扩张或细支气管扩张,这一模式与纤维化相符。右肺上、中、下叶的楔形活检结果显示机化性肺炎。
![图片[18]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727519.png)
图18非特异性间质性肺炎(NSIP)。51岁女性皮肌炎患者行CT平扫。通过下肺基底的轴位(A)和矢状位(B)图像显示双肺下叶实变,双侧胸膜下和磨玻璃。矢状位图像上支气管明显扩张(B)。这些表现与机化性肺炎和NSIP重叠一致。
![图片[19]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727520.png)
图19非特异性间质性肺炎(NSIP)。我们对一名病态肥胖且进行性呼吸困难的67岁男性进行了轴位CT扫描。肺基底部CT显示周围支气管壁增厚,伴有边界不清的磨玻璃密度和小叶周围增厚,特别是在左基底部(箭头),这些表现提示NSIP。外科肺活检结果与机化性肺炎相符。
病理特征
在本文中,“OP”是一个临床术语,包括COP和SOP。为了区分,在讨论病理结果时,“OPP”用于OP的组织学特征。
低倍镜下,OPP呈斑片状,与结节样机化区域相邻的肺相对正常(图20)。机化性纤维化包括腔内疏松结缔组织息肉样塞子,突出到远端气腔。肺泡间隙和肺泡管通常受影响最大,细支气管受影响较小(图20A, 20B),在某些情况下,活检标本未见细支气管受累。OPP结节可以位于细支气管周。少见的是,它们可能出现在小叶周围,与CT扫描所见的小叶周围型相对应(图21)。所有的结缔组织似乎都是大致相同时期,肺的结构完整。来自COP或SOP患者的外科活检标本通常表现为OPP的多中心病灶,在FOP中,组织学外观与COP或SOP相似,但它由一个孤立的局限性结节组成(图20C, 20D)。间质纤维化不明显或不存在。没有看到蜂窝状改变。由于远端气道闭塞,可能出现内源性类脂性肺炎,由充满脂质的泡沫巨噬细胞在肺泡积聚。肺泡纤维蛋白渗出物可能存在,但通常是局灶性的。间质性慢性炎症通常为轻度至中度。2型肺细胞增生通常不明显。
![图片[20]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727521.png)
图20 机化性肺炎(OP)的组织学表现(OPP)。在这个多灶性肺受累的隐源性OP病例中,低倍镜组织学图像(A)显示斑片状疏松结缔组织形成的息肉样腔内栓子(粗箭头)区域,突出到远端气道。邻近的肺实质相对正常(细箭头)。B,图示肺泡腔和肺泡管内可见息肉样栓子(粗箭头),但细支气管受累很少(细箭头)。结缔组织时期相同,肺泡结构保留。C,本例局灶性OP,如(a)和(B)所示,可见由OPP组成的结节性病变,周围是相对正常的肺(细箭头)。D,病变由远端气腔疏松结缔组织的息肉样栓子组成(粗箭头)。
![图片[21]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727522.png)
图21 小叶周围机化性肺炎(OPP)。A,在上叶水平获得的轴位CT扫描图像显示右肺周边的小叶周围阴影(箭头)。B,在这个外科肺活检标本中,OPP的病变(粗箭头)在组织学上也位于小叶的外围,远离小叶中心的细支气管(细箭头)。C,中倍镜突出显示小叶边缘的OPP病灶(粗箭头),远离小叶中心的细支气管(细箭头)。D,高倍镜显示疏松结缔组织的息肉样栓子突出到远端气腔(粗箭头)。
OPP的组织学特征可以在各种情况下遇到。尽管潜在疾病有时在活检标本上表现出提示性特征,但仅通过组织学检查可能无法将COP与SOP区分开来。在某些情况下,肺组织的组织学活检,即使是大量的外科肺活检标本,也会产生误导。标本可能只显示极少量的OPP和大多数其他发现,如NSIP(图22)。在这些病例中,除非CT扫描进行影像学-病理相关性检查,否则可能忽略主要的肺实变累及,提示OPP的初步诊断。
![图片[22]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727523.png)
图22继发性机化性肺炎(OP):影像学-病理相关性。A,外科肺活检标本上,这个病人患有干燥综合征,以非特异性间质性肺炎(NSIP)为主要病变类型。淋巴细胞和浆细胞弥漫性间质浸润,导致肺泡壁轻度增厚。有许多淋巴聚集(箭头)。B,局灶性OP表现为远端气腔内疏松结缔组织的息肉样栓子(箭头)。C,患者俯卧位的轴位CT扫描显示支气管周围的实变区域,并伴有OP特有的支气管充气征。还注意到双侧磨玻璃影和网状影,提示NSIP。外科活检结果显示以NSIP为主,轻度局灶性OP。活检标本的OP程度被低估,可能是因为它位于支气管周围且远离胸膜,而NSIP模式主要累及胸膜下区域。该病例的影像学和病理相关性表明,CT扫描结果优于外科肺活检结果,在这种临床情况下,诊断为干燥综合征相关的继发性OP。
有三种罕见的与OP相关的组织学模式(表3):(1)瘢痕性OP(图23A、23B),(2)AFOP(图23C、23D),(3)肉芽肿性OP(23E、23F)。这些罕见的组织学模式具有不同于COP、SOP和FOP的临床特征。
瘢痕性OP的管腔结缔组织息肉样栓子与COP相同,但也含有致密的纤维胶原蛋白,而不是通常OPP所特有的纯粹由疏松结缔组织组成(图23A,
23B),可能与树状骨化有关(图23A)。AFOP组织学模式可出现在一系列临床环境中,从可能类似于COP或SOP的相对惰性的临床表现,到炎症的患者可出现呼吸衰竭,以及提示该疾病更符合弥漫性肺泡损伤的临床表现。在后一种情况下,可能存在病例样本采集问题,即在肺活检标本中无法获得更明确的DAD组织学特征。肉芽肿性OP是另一种不常见的发现,活检标本显示OPP和非干酪性肉芽肿性炎症混合存在。在这种情况下,应格外小心,以排除感染、结节病、胶原血管疾病或药物毒性。坏死性肉芽肿的存在倾向于感染。
表3 OP病理学罕见类型
| 类型 | 表现 | 治疗和结局 |
| 瘢痕性OP | 这种类型可发生在COP或SOP的情况下,表现与非瘢痕病例相似。 | 惰性过程,结局良好 |
| AFOP | 这种类型有CAP样的影像,炎症标志物显著升高,表现为非特异性症状。 | 根据基础疾病和临床表现,治疗策略有很大差异,包括抗生素、皮质类固醇和其他免疫抑制剂(包括环磷酰胺)。结局差异较大。 |
| GOP | 临床表现可能与咳嗽、呼吸困难和喘息有关。 | 这种类型在临床上引起的症状比其他类型少。通常不需要特别的治疗 |
![图片[23]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727524.png)
图23罕见的组织学模式:瘢痕性OP模式(OPP)、AFOP以及肉芽肿性OP
(GOP)。A, B,瘢痕性OPP。该活检标本显示远端气道内结缔组织的息肉样栓子,但大部分由嗜酸性致密胶原(粗箭头)组成。这种致密的纤维组织与OPP中常见的邻近疏松的纤维组织(细箭头)形成对比。此外,还有与远端气腔内息肉样栓相关的骨状结构,呈树突样骨化(弯曲箭头)。C, AFOP。该活检标本显示许多气道内(箭头所示)广泛的纤维蛋白和明亮的嗜酸性表现,以及疏松结缔组织的息肉样栓子。D,该活检标本中的大多数肺泡腔显示除OPP病变外远端气腔有嗜酸性纤维蛋白(粗箭头)聚集。E,GOP。活检标本显示除了多发性非干酪性肉芽肿(粗箭头)外,还有结节状浸润,提示OPP。F,高倍镜显示远端气腔内疏松结缔组织的腔内息肉样栓子(细箭头),邻近圆形上皮样组织细胞形成的非干酪性肉芽肿(粗箭头)。
活检标本大小
活检标本越大,对OPP做出明确病理诊断的机会就越大,但如图22所示,即使在外科肺活检获得的大量组织中,可能漏掉OP病变而通过CT扫描也可识别OP(CT扫描结果可以更准确地反映主要病变(OP或NSIP)是什么)。在小活检标本如TBBX标本(图24A、24B)、针吸活检标本(图24C、24D)或经支气管冷冻活检标本(图24e、24F)中,可能可以识别出OPP,但由于肺组织缺乏,寻找相关病理过程的组织学线索是很困难的。这些相关病理过程包括DAD(图25A、25B)或潜在病因,如肿瘤(图25C、25D)、脓肿(图24C、24D)或梗死(图25E)。因此,如果识别OPP的基础是一小块肺组织,则必须特别仔细地将活检结果与临床和影像学图像相关联,在确定COP或SOP的诊断之前,这些图像应该是代表性的。诊断过程中应考虑根据治疗反应进行适当随访。
![图片[24]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727525.png)
图24 经支气管活检、粗针穿刺活检和经支气管冷冻活检标本。A,经支气管活检标本。此宽大的经支气管活检标本显示远端气道内疏松结缔组织的多个息肉样栓子(箭头所示)。B,高倍镜显示疏松结缔组织的息肉样栓子(箭头所示)突入肺泡腔。也存在轻度间质慢性炎症浸润。C,核心穿刺活检标本。在该患者获得的多芯活检标本之一中,唯一的发现是机化性肺炎,并在远端气道中有多个腔内疏松结缔组织的息肉样栓子(箭头)。D,另一个穿刺活检标本显示急性脓肿伴肉芽组织(箭头所示)和许多中性粒细胞。革兰染色结果显示大量革兰阳性菌,染色呈深蓝色(插入图片)。E, F,冷冻支气管活检标本。此冷冻活检标本显示OPP,在远端气道内有均匀分布的疏松结缔组织息肉状栓(箭头所示)。间质炎症极少,肺泡结构保存。
鉴别诊断(病理方面)
临床OP (COP或SOP)必须通过多学科方法与活检标本中观察到的组织学或影像学OPP进行鉴别,或通过CT扫描作为其他ILDs的组成部分或作为非特异性反应性病变进行鉴别(表4)。在ILDs中,OPP可被视为:(1)在ILDs(如UIP、NSIP或HP)中出现的轻微病变;(2)作为组织型急性肺损伤的组成部分,如DAD;(3)作为UIP或特发性肺纤维化或各种其他ILDs(包括NSIP或HP)急性加重的表现,在活检标本和/或CT扫描中也存在这些慢性ILDs的基础疾病;(4)肺损伤的混合模式,特别是NSIP合并OP或嗜酸粒细胞性肺炎合并OP。通过CT扫描和/或活检很难区分OPP和嗜酸性粒细胞肺炎,特别是如果患者在活检前接受了糖皮质激素,导致组织中嗜酸性粒细胞数量显著减少。
在病变主要是OPP的病例中,应评估活检标本是否有提示SOP潜在病因的特征,如显著的慢性间质性炎症(药物毒性、胶原血管疾病[图22])或放射性肺炎。最后,OPP必须与其他ILD相区别,尤其是DAD的机化期,该期表现为明显的腔内出芽纤维化,与OPP相似。DAD与OPP的区别在于肺受累呈弥漫性而非斑片状(图25A、25B),常伴有反应性细胞异型性(图25B)、机化性纤维化导致间质增厚(图25A、25B)、透明膜(图25A)和/或急性炎症和出血灶。与DAD患者不同,COP患者通常可游走,胸部影像学显示如上所述的斑片状结节性浸润(图26)。
NSIP与COP相关的OPP相比表现出更明显的慢性间质炎症。OP病灶常出现在NSIP中,但它们是局灶性的,而不是主要的组织学表现。鉴于CT扫描结果可能提示COP或SOP等其他诊断,因此活检标本显示NSIP模式时,影像学与病理学的相关性很重要(图22)。换句话说,CT扫描结果可以更准确地反映主要病变(OP或NSIP)是什么,即使在活检标本中,包括外科肺活检标本可能不能准确地反映主要病变类型。
如果有OPP的活检标本也显示中性粒细胞聚集或坏死性肉芽肿,应排除COP或SOP的诊断。OPP与缩窄性(或闭塞性)细支气管炎的主要区别在于前者远端气腔内存在疏松纤维化的息肉状栓子,而后者则存在导致细支气管内狭窄的同心圆(向心性)致密纤维化(图25F)。如果肺泡纤维蛋白渗出明显,应考虑AFOP。OPP必须与对潜在病变非特异性反应鉴别,如脓肿(24C,24D),肿瘤(25C,25D),坏死性肉芽肿或急性肺炎。
| 类型 | 描述 | |
| COP | 暂未找到病因的OP,肺内的主要病理过程是OP模式。 | |
| SOP | 原因已知的OP | |
| 病因 | 例子 | |
| 感染后 | 细菌,病毒,寄生虫,真菌,分枝杆菌 | |
| 药物相关 | 抗生素、抗癫痫药、抗心律失常药、免疫抑制剂 | |
| 吸入(有毒化学物质) | 可卡因吸入、硫化氢、工业气体、电子烟 | |
| 吸入(胃内容物) | ||
| 移植 | 骨髓移植,肺移植,肝移植 | |
| 放射治疗 | 尤其是在乳腺癌方面 | |
| 自身免疫性疾病 | 类风湿关节炎,SLE, 干燥综合征,皮肌炎,多发性肌炎 | |
| 其他 | 炎症性肠病,风湿性多肌痛,冠状动脉旁路移植术 | |
| 非SOP/COP的疾病具有OP模式 | ||
| OP类型根据病理检查或CT扫描作为其他ILD的组成部分 | ||
| 病因 | 例子 | |
| ILD中较少的OP病变 | UIP,NSIP,HP | |
| 急性肺损伤的组成部分 | DAD | |
| UIP或IPF或各种其他ILD (包括NSIP和HP)的急性加重表现 | ||
| 混合 | NSIP合并OP或嗜酸粒细胞性肺炎合并OP | |
| 对另一过程的非特异性反应,常发生在潜在的原发性肺疾病的外围 | ||
| 病因 | 举例 | |
| 原发性肺癌 | 肺癌或淋巴瘤 | |
| 肺梗死 | ||
| 吸入 | ||
| 肺脓肿 | ||
| 血管炎或出血 |
![图片[25]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727526.png)
图25机化性肺炎(OPP)的鉴别诊断A,弥漫性肺泡损伤OPP。该活检标本显示弥漫性累及机化结缔组织,导致肺泡壁增厚(厚箭头)和相关透明膜(薄箭头),由密集的粉红色透明渗出物组成,沿肺泡壁表面排列。B,除了疏松的结缔组织导致肺泡壁增厚(粗箭头)外,还有明显的肺细胞增生伴一些不典型特征(细箭头)。C,鳞癌旁OP。鳞状细胞癌周围的肺实质(粗箭头)包含OPP区域(细箭头)。鳞状细胞癌由具有角化特征的肿瘤细胞巢组成(插入图片)。D, OP由远端气道内疏松结缔组织构成的息肉样栓子(箭头所示),类似于隐源性OP或继发性OP。E,梗死周围的OP。梗死灶由圆形的嗜酸性死肺组织(粗箭头)组成。它被纤维炎症反应包围,有明显的OP成分(曲线箭头)。F, 缩窄性细支气管炎(也叫闭塞性细支气管炎)。图示细支气管的同心圆纤维化层(箭头所示)位于上面的呼吸道黏膜和下面环绕细支气管的正常平滑肌之间。这种纤维化引起细支气管腔明显狭窄。
![图片[26]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727527.png)
图26弥漫性肺泡损伤和机化性肺炎。一名经活检证实弥漫性肺泡损伤的66岁女性患者的正位胸片(a)显示双侧弥漫性实变,一名经活检证实的机化性肺炎的37岁男性患者(B)显示双侧斑片状、结节状阴影。
诊断流程
OP的诊断常常具有挑战性。临床表现无特异性,通常以咳嗽和/或呼吸困难为特征的呼吸系统表现,常伴有明显的全身症状。更为复杂的是,OP的症状和体征与感染、恶性肿瘤和结缔组织疾病(如血管炎)完全重叠。OP的诊断和治疗需要全面的诊断检查和持续的随访。然而,临床医师可以通过考虑图1所示的算法来诊断和治疗疾病。
将OP纳入鉴别诊断通常是由于患者持续的(通常是非特异性的)临床特征和异常胸部影像学结果相结合而引发的临床怀疑。高分辨率CT (HRCT)扫描是推荐的(这在我国应该是常规的),因为它的敏感性和可重复性,以帮助识别特定的成像模式,可以预测潜在的组织病理学模式。通过结合临床资料和HRCT影像模式,可以显著缩小以非特异性症状和异常胸片为表现疾病的鉴别诊断。
尽管临床表现通常是非特异性的,但对其进行界定是至关重要的,因为OP可以表现为原发性(或特发性)或继发性疾病。临床病史,如近期呼吸道感染,潜在的全身疾病,或已知与OP发展相关的治疗,当结合特定的胸部影像学模式时,可以显著增加做出准确诊断的可能性。
在HRCT扫描中,OP通常表现为三种主要模式:实变、结节和线状或网状(见放射学特征)。在这些模式中,有更多的典型和非典型的发现与OP的存在相关。考虑到诊断的复杂性,在正式的多学科讨论中回顾临床背景和HRCT扫描可能会增加诊断的准确性。
在最初的多学科讨论后,根据个人的诊断可信度,可选择单独观察、经验性治疗、支气管镜联合BAL或组织诊断(通过各种技术)等适当的策略。无论计划如何,持续的临床和胸部影像学特征的纵向随访是绝对必要的。
鉴别诊断
尽管一些影像学表现是典型的OP,但不具有特异性。因此,必须牢记在胸部CT扫描中可能遇到的各种影像学表现的鉴别诊断(表2)。实变是OP病例中最常见的影像学表现之一,但在咳嗽、呼吸困难和发烧的患者中,实变更可能是继发于感染。
当出现持续的游走性实变且对抗生素治疗无反应时,必须考虑包括OP在内的鉴别诊断。游走性斑块影可提示感染、血管炎和复发性出血。当病变无游走性时需要考虑腺癌和低级别B细胞淋巴瘤(特别是与粘膜相关的淋巴组织淋巴瘤)。
OP的实变通常是外围的。当存在外周实变时,可考虑多种疾病,包括慢性嗜酸性粒细胞性肺炎、肺淋巴瘤、肺梗死、肺泡出血、病毒感染和吸入性肺炎。同样,类似于支气管血管周围实变分布的情况也常见于OP,包括结节病、卡波西肉瘤、滤泡性细支气管炎、肉芽肿性多血管炎、肺癌和淋巴瘤。
OP也可表现为单发结节或多发结节或肿块,需要与恶性疾病鉴别。孤立性小结节的鉴别诊断包括腺癌(尤其是肺上叶)和感染。较大肿块和/或肿块样实变灶的鉴别诊断包括淋巴瘤、多中心腺癌和侵袭性真菌感染(特别是在免疫功能低下的患者中)。当存在单发或多发结节时,常对原发性肺癌或转移性疾病进行活检评估。此外,感染和结节病可能有相似的影像学表现。
GGO(单独或呈铺路石状)是OP的另一常见胸部CT表现。同样,对于此类表现,需要进行广泛的鉴别诊断。鉴别诊断包括肺泡蛋白沉积症,感染(如耶氏肺孢子菌肺炎),结节病,外源性脂质性肺炎,粘液腺癌,以及呋喃妥因诱导的OP。就目前的相关性而言,COVID-19的典型外观与OP的外观有显著重叠(图27)。与电子烟或电子烟产品使用相关的肺损伤是另一个患病率不断上升的疾病,其结果可能与OP的结果相同(图28)
![图片[27]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727528.png)
图27 COVID-19和机化性肺炎(OP)。一名55岁男性确诊COVID-19, CT表现典型。肺中部(A)和肺下段(B)的CT平扫图像显示右肺上叶磨玻璃影(GGO)伴小叶内间隔增厚,各肺下叶周边均有GGO和实变影,左肺下叶为小叶周围型。这些表现也是典型的OP。
![图片[28]-CHEST综述:机化性肺炎的诊断流程(临床-影像-病理特征相关性) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/10/727529.png)
图28 电子烟或电子烟产品使用相关的肺损伤(EVALI)和机化性肺炎(OP)。一名有电子烟吸烟史的36岁男性出现重度呼吸急促和低氧血症。薄层CT平扫显示双侧大面积实变和磨玻璃影,双侧小叶间隔增厚。外科肺活检结果显示弥漫性肺泡损伤,考虑为EVALI。这种影像学模式也可见于OP。
CT扫描小叶周围型是指与小叶间隔相邻的模糊的拱状和多边形不透明影,偶尔见于OP。然而,在感染、慢性嗜酸性粒细胞性肺炎、淋巴增生性疾病和肺癌中也可能出现这种情况。
环礁征或反晕征是OP可能出现的另一种CT扫描表现。虽然被认为是提示性表现,但这不是一种特异性表现,因为侵袭性真菌感染、慢性嗜酸性粒细胞性肺炎、抗中性粒细胞胞质抗体相关性血管炎、肺梗死、COVID-19、结节病、淋巴瘤和腺癌也可能产生这一表现。
在OP病例中,肺实质带可沿支气管径路向胸膜延伸。这种表现可能被误认为是感染或ARDS引起的瘢痕,也可能见于石棉肺患者。(有人认为,这些管路是由于更近端的气道受累导致狭窄支气管远端的线性肺不张,或者可能继发于胸膜实质纤维化)
与OP相关的典型胸部CT影像学表现并不具有特征性。每种疾病都有广泛的鉴别诊断,往往导致诊断延迟。然而,当结合患者的病史和临床情况,它们可能会帮助医生做出正确的诊断。
结论
本文就OP的影像学和病理学表现进行综述。包括医师诊断这种临床实体及其常见亚型的流程指南。由于OP的非特异性,临床和实验室标志物均无特异性,因此需要高度怀疑OP的诊断。OP在HRCT上没有明确的影像学表现,双基底、支气管血管周围和/或周围实变是最典型的影像学表现,占75%。其他影像学特征包括单发或多发结节和线状或网状表现。可能需要通过外科活检或支气管镜、BAL和TBBX进行组织病理学确认。充分的组织取材,结合影像学检查结果,对于明确的病理诊断是必不可少的。组织活检标本上的OPP不能用于区分COP和SOP,尽管某些病理特征可能提示SOP的潜在原因。OPP必须区别于其他ILD,尤其是DAD的组织阶段。如果临床高度怀疑、典型的影像学检查结果和侵入性操作的风险高,则可以启动经验性治疗。为了对OP进行正确的诊断、治疗和随访,通常需要结合临床、影像学和组织学检查结果的多学科方法。
往期推荐
本文原文(Cherian SV, Patel D, Machnicki S, et al. Algorithmic Approach to the Diagnosis of Organizing Pneumonia: A Correlation of Clinical, Radiologic, and Pathologic Features. Chest. 2022;162(1):156-178. ),翻译仅为学习交流用,侵删!
欢迎指正相关错误。
如需下载原文,可公众号回复“机化性肺炎”获取下载链接。
欢迎转发(公众号转发请备注来源)。
本文使用 文章同步助手 同步






暂无评论内容