Beasley 在 2002 年首次描述了一系列肺损伤患者的急性纤维蛋白性和机化性肺炎 (AFOP)。2013年,美国胸科协会/欧洲呼吸学会发布了关于特发性间质性肺炎的最新分类,AFOP被确认为特发性间质性肺炎的一种罕见的病理学类型。截至2018年,全球文献报道不足160例。
AFOP是特发性间质性肺炎的一种罕见病理学类型,可以是特发性或继发性。据目前国内外文献报道,其主要与感染、自身免疫性疾病、免疫功能状态改变、血液恶性肿瘤、药物不良反应、职业及环境暴露等因素相关。主要分为两种模式急性爆发型 AFOP和亚急性AFOP。
病理表现
![图片[1]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1663986633-image.png)
图1 AFOP的组织病理学表现为镜下肺泡腔内可见大量纤维素性渗出物,其典型特点主要为:1 )肺泡腔内可见明显的广泛分布的“均质嗜酸性纤维素球”样物质;2)与OP改变相似,AFOP的纤维素球中几乎均具有不同程度的OP表现;3)肺泡腔内纤维蛋白分布不均匀,约50%的肺泡腔受累,未形成透明膜,嗜酸性粒细胞及巨噬细胞无明显聚集表现,无肉芽肿性炎症形成,无明显成纤维细胞
活动。AFOP的次要特点为肺泡间隔可见增宽,伴II型肺泡上皮细胞增生。急、慢性炎症细胞浸润可见于受累肺泡的肺泡间隔内,且病灶之间的肺组
织基本正常。
肺CT表现
AFOP的胸部CT影像学特点主要为双侧弥漫性分布且以基底部为主的磨玻璃影或融合状斑片影。其中急性起病、进展迅速的患者胸部CT影像表现与DAD类似,以基底部为主的实变和磨玻璃阴影为主要表现;而亚急性起病患者在胸部C T影像表现上与COP类似,最常见表现为双肺多发的、游走的、分布不均匀的弥漫磨玻璃影、斑片状实变影,以外周和双肺底分布为主;也可表现为沿支气管血管束周围分布的肺实变,在实变部位的支气管扩张、支气管壁增厚;双肺弥漫的粟粒样结节影,一侧孤立性肺大片实变影。偶见晕征、反晕征。[1]
![图片[2]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1663996004-image.png)
a片状或块状的空域合并。
b磨玻璃影。
c网状和线状混浊。
d多个结节[2]
![图片[3]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1663996482-image.png)
CT 图像 A 和 B 来自一名 45 岁男性,显示斑片状和弥漫性磨玻璃影(GGO),支气管血管周围实变(GGO/实变主导型)。
CT 图像 C 和 D 来自一名 52 岁男性,显示双肺不明确的结节性混浊(结节显性型)。
CT 图像 E 和 F 来自 40 岁男性,显示双肺纤维化带伴弥漫性 GGO/实变(纤维化主导型)。图 F 可见少量双侧积液[3]
![图片[4]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1663996994-image.png)
(A) 晕征:GGO 包围的结节性实变。
(B) 反转光环标志:GGO 的圆形区域被一圈实变环包围。
(C, D) OP 模式:轴位和冠状位 HRCT 图像显示斑片状、外周为主的多发性实变,伴有空气支气管征。
(E,F)NSIP 模式:弥漫性、胸膜下主要网状结构和 GGO 伴牵拉性支气管扩张。
(G,H)NSIP 和 OP 模式:双侧下部区域、支气管血管周围主要实变和 GGO 伴牵拉性支气管扩张。[4]
![图片[5]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1664002060-image.png)
(A-C)患者 1,患有 AFOP 的 COP。(A) HRCT 显示右上叶 GGO 胸膜下斑片状空域实变。(B, C) TBLB 获得的组织学结果显示机化性肺炎和肺泡内多发性纤维蛋白病灶,这与 AFOP 的结果一致。(D-F) 患者 2,伴有 AFOP 的放射性肺炎。(D) 左上叶 GGO 的胸膜下支气管充气征。(E, F) TBLB 获得的组织学结果显示肺泡内纤维蛋白的多个病灶和肺泡壁淋巴细胞浸润。(G-I) 患者 3,IgG4 相关性肺病伴 AFOP。(G) 胸膜下不规则形式的实变和肺泡内间隔增厚。(H,I)通过外科肺活检获得的组织学结果显示肺泡内纤维蛋白和肺泡壁中浆细胞和淋巴细胞的浸润。(J-L) 患者 4,无 AFOP 的 COP。(J) 右上叶胸膜下空域实变。(K, L) TBLB 获得的组织学结果显示机化性肺炎伴有肺泡内肉芽。未观察到肺泡内纤维蛋白沉积。[4]
![图片[6]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1664003866-image.png)
![图片[7]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1664004052-image.png)
![图片[8]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1664004484-image.png)
![图片[9]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1664004623-image.png)
(A) 肺泡内的肺泡内纤维蛋白沉积。纤维蛋白占样本的四分之三以上(苏木精和伊红染色,×1)。PA:肺动脉,MB:膜性细支气管
(B) 这种病变的特点是肺泡内纤维蛋白呈纤维蛋白“球”和间质炎症,但没有形成透明膜(苏木精和伊红染色,×10)。➡纤维蛋白球
(C) 该病灶显示纤维蛋白积聚,肺泡间隙偶有肺泡内息肉样纤维化。▲息肉样纤维化。[6]
诊断
AFOP的诊断依赖于大块肺组织活检标本,典型表现为镜下见广泛分布的嗜酸性纤维素球,且不形成透明膜、Masson小体形成或大量嗜酸粒细胞浸润,结合临床和胸部CT影像表现完全排除DAD,OP及EP等其他急性肺损伤病变后,可考虑诊断为AFOP。目前活检最佳的方法是电视辅助胸腔镜下肺活检或CT引导下经皮肺穿刺活检。临床仅仅基于影像学表现或组织病理学表现来诊断AFOP是不可取的,需要临床、影像学及组织病理学检查三者密切结合,并排除DAD,OP及EP等其他急性肺损伤等病变。
鉴别诊断
由于AFOP在组织病理学上常与COP,DAD及嗜酸性粒细胞肺炎(eosinophil pneumonia,EP)相伴随,因此需完全排除COP,DAD及EP等多种急性肺损伤病变后才能确诊AFOP。
AFOP 与 DAD 不同主要因缺乏由脱落上皮细胞和纤维蛋白构成的“透明膜”;AFOP与OP的鉴别为肺泡及肺泡管内无纤维细胞、成纤维细胞增殖形成的Masson 小体,组织肺泡内纤维蛋白是 AFOP 的主要发现,而组织成纤维细胞组织应该是 OP 的主要发现。EP的组织学特点是镜下可见肺泡内大量纤维蛋白、巨噬细胞及嗜酸性粒细胞混合聚集,部分可见大量嗜酸性粒细胞聚集于肺间质,形成嗜酸性微脓肿。OP的组织病理学特点表现为呼吸性细支气管、肺泡管和肺泡内出现明显的纤维组织及纤维母细胞增生,形成Masson小体;同时病灶区肺泡间隔有时可见轻微的慢性炎症渗出表现,肺泡内几乎没有纤维素沉积。DAD是ALI/ARDS的一种典型的组织学表现,其主要的组织病理学特点为镜下肺泡内可见部分炎症细胞浸润及大量的“嗜酸性透明膜”形成,为弥漫性分布。
下图是与DAD和EP鉴别的病理图片
![图片[10]-急性纤维素性机化性肺炎(AFOP) | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/09/1664006628-image.png)
图 10-2. 弥漫性肺泡损伤,机化阶段。在右上角可以看到残留的透明膜。间质显示由粘液样成纤维细胞组织显着扩张。也存在明显的 2 型肺细胞增生
图 10-3. 弥漫性肺泡损伤,机化阶段。粘液样间质纤维化和明显的 2 型肺细胞增生是该阶段的特征。致密的胶原纤维化不是特征
图 10-4. 急性嗜酸性粒细胞性肺炎。与弥漫性肺泡损伤相似,可能存在透明膜和肺细胞增生,但还存在明显的嗜酸性粒细胞。
图 10-5. 急性嗜酸性粒细胞性肺炎。嗜酸性粒细胞存在于透明膜和肺泡间隙以及间质中,左下方可见。
图 10-6. 急性纤维蛋白性和机化性肺炎。与透明膜相反,存在组织肺泡内纤维蛋白。可能存在轻度慢性炎症、粘液样纤维化和肺细胞增生,但应不存在明显的嗜酸性粒细胞和中性粒细胞[7]
治疗
AFOP目前国内外尚无统一标准的治疗方案,糖皮质激素是其主要的治疗药物,但其剂量和疗程尚未统一确定。目前糖皮质激素的首次冲击剂量最大可达到1 000 mg/d。治疗疗程根据病因、临床表现、胸部CT影像学变化及病程等各有不同。但在减量的过程中可能复发或者恶化,恢复高剂量时仍然有效。其他有效的药物和治疗措施包括霉酚酸酯、环磷酰胺及咪硫唑嘌呤、免疫球蛋白、肿瘤坏死因子抑制剂、机械通气、体外生命支持技术、肺局部手术切除及肺移植等。
其中一篇文献中指出关于类固醇逐渐减量方案,口服皮质类固醇的初始剂量为 0.5-0.8 mg/kg/天,具体取决于临床表现(患者的症状、阴影范围、临床过程或基础疾病)。对于符合急性肺损伤标准(PaO 2 /FiO 2< 300 mmHg),在静脉注射甲基强的松龙(1000 mg/天)3天后,初始剂量为1.0 mg/kg/天。根据临床过程,治疗基本上每 1-2 周逐渐减少到 5-10 mg/天。对于复发的患者,重新给予皮质类固醇或将其增加到初始剂量的大约一半,并以与监测治疗效果相同的方式逐渐减量。此外,根据基础疾病和复发频率考虑给予免疫抑制剂或红霉素[4]。
预后
急性爆发型 AFOP:临床上大多数患者病情进展迅速且危重,早期即可出现急性呼吸衰竭并迅速发展至死亡;约30%的AFOP患者需糖皮质激素联合机械通气或体
外膜肺氧合等辅助治疗,病死率高达90%。
亚急性 AFOP亚急性患者大多数病情进展较缓,一般治疗效果好,预后尚可。目前临床上主要的治疗药物是糖皮质激素类药物联合免疫抑制剂(如环磷酰胺或吗替麦考酚酯),多数患者可在治疗数月后基本痊愈,但由于首次冲击时间、用药剂量及患者的依从性等不同,部分患者可能出现症状的反复,从而延长临床治疗时间。如果条件允许,可外科手术行病灶部位肺部分切除术或肺移植。临床上确诊AFOP的患者预后较差,病死率接近50%[1]。
以 GGO/巩固占主导地位的放射学发现的患者死亡率往往最高,但无统计学意义。
参考文献
[1]文誉.急性纤维素性机化性肺炎的研究进展[J].临床与病理杂志,2019,39(8):1810-1814.DOI:10.3978/j.issn.2095-6959.2019.08.030.
[2]Lee, Jong Hyuk et al. “Diagnostic procedures and clinico-radiological findings of acute fibrinous and organizing pneumonia: a systematic review and pooled analysis.” European radiology vol. 31,10 (2021): 7283-7294.
[3]Kim, Min Chul et al. “Clinical features and long-term prognosis of acute fibrinous and organizing pneumonia histologically confirmed by surgical lung biopsy.” BMC pulmonary medicine vol. 22,1 56. 8 Feb. 2022
[4]Onishi, Yasutaka et al. “Clinical features of acute fibrinous and organizing pneumonia: An early histologic pattern of various acute inflammatory lung diseases.” PloS one vol. 16,4 e0249300. 1 Apr. 2021, doi:10.1371/journal.pone.0249300
[5]Lu J, Yin Q, Zha Y, Deng S, Huang J, Guo Z, Li Q. Acute fibrinous and organizing pneumonia: two case reports and literature review. BMC Pulm Med. 2019 Aug 5;19(1):141. doi: 10.1186/s12890-019-0861-3. PMID: 31382933; PMCID: PMC6683570.
[6]Shintani, Ryota et al. “Transbronchial lung cryobiopsy in idiopathic acute fibrinous and organizing pneumonia.” Respiratory medicine case reports vol. 28 100888. 18 Jun. 2019,
[7]Kenneth T. Hughes, Mary Beth Beasley; Pulmonary Manifestations of Acute Lung Injury: More Than Just Diffuse Alveolar Damage. Arch Pathol Lab Med 1 July 2017; 141 (7): 916–922.
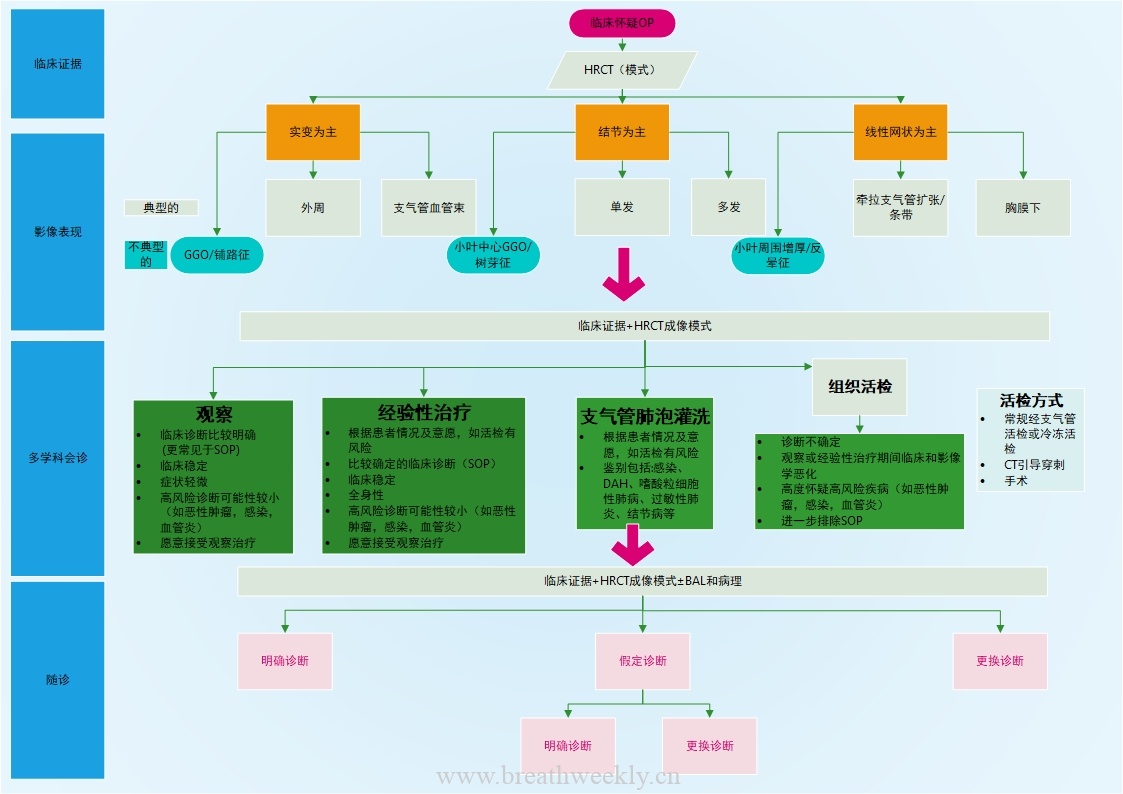
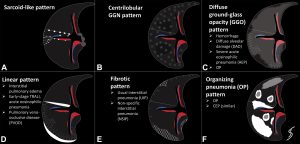
[8][Cherian, Sujith V et al. “Algorithmic Approach to the Diagnosis of Organizing Pneumonia: A Correlation of Clinical, Radiologic, and Pathologic Features.” Chest vol. 162,1 (2022): 156-178. doi:10.1016/j.chest.2021.12.659]






暂无评论内容