翻译:慕壮壮
(柳叶刀呼吸医学综述McCarthy C, Gupta N, Johnson SR, Yu JJ, McCormack FX. Lymphangioleiomyomatosis: pathogenesis, clinical features, diagnosis, and management. Lancet Respir Med. 2021 Nov;9(11):1313-1327. doi: 10.1016/S2213-2600(21)00228-9. Epub 2021 Aug 27. PMID: 34461049.)
本文关键点
·在胸部CT扫描上符合肺囊性疾病的女性中,下列任何一种的额外存在足以在不需要肺活检的情况下建立淋巴管平滑肌瘤病( LAM )的明确诊断:结节性硬化症( TSC )、血清血管内皮生长因子D 升高( VEGF - D≥ 800 pg / m L )、肾血管平滑肌脂肪瘤、淋巴管平滑肌瘤或乳糜积液。
·对患有自发性气胸的育龄妇女进行高分辨率CT筛查,有助于及时识别LAM。
·对疑似LAM的女性的初步评估应包括血管平滑肌脂肪瘤的筛查、淋巴管受累以及是否存在未被诊断TSC。
·LAM的疾病表现和进展速度是高度可变的,最好是通过个性化的治疗和监测计划来管理。
·mTORC1抑制剂可减少肺功能丧失、乳糜堆积、血管平滑肌脂肪瘤生长,是LAM患者的一线治疗手段。
·气胸的早期明确治疗降低了自发性气胸复发相关的发病率,这应在初次发作后而不是复发事件后考虑;既往胸膜固定术并非未来肺移植的禁忌证。
摘要
淋巴管平滑肌瘤病( LAM )是一种进展缓慢、低级别、转移性的女性肿瘤,其特征是肺实质浸润异常平滑肌样细胞,导致肺囊性破坏。LAM的入侵细胞来源不明,并带有结节性硬化症 ( TSC )基因的突变,导致雷帕霉素靶蛋白( mTOR )信号通路的组成性激活,细胞增殖失控,淋巴管生成受阻,最终导致肺重塑紊乱和呼吸衰竭。在过去二十年中,LAM在基础和临床科学的各个方面都取得了重要进展,包括对分子机制的认识得到了提高、新的诊断和预后生物标志物、有效的治疗策略以及全面的临床实践指南。为了更好地了解LAM的自然历史,还需要进一步的研究;开发更强大的诊断、预后和预测性生物标志物;优化mTOR复合物1抑制剂在LAM治疗中的使用;并为缓解诱导疗法的发展探索新的途径。
引言
淋巴管平滑肌瘤病( LAM )是一种罕见的、缓慢进展的全身性疾病,常伴有肺囊性破坏、腹腔肿瘤和乳糜液集聚(胸、腹),这是由LAM肿瘤细胞浸润引起的。这些细胞来源不明,可能通过淋巴系统或血流到达肺。放射学证据显示,LAM见于大多数女性(30-60%)和高达10%的伴有结节性硬化症(TSC) 的男性,这是一种多系统遗传疾病,由TSC基因、TSC1或TSC2的生殖系统突变引起。发生于基础TSC患者的LAM称为TSC - LAM。由于TSC2基因的体细胞突变,这种疾病也可能在没有TSC的女性中零星发生,称为散发性LAM。进行性劳力呼吸困难和自发性气胸是LAM最常见的临床表现。气胸易反复发作( 平均每例患者 3 – 4次 ),是主要的发病来源,往往需要多次干预。血管平滑肌脂肪瘤发生在大多数TSC-LAM患者和约30-40%的散发性LAM患者中,有淋巴表现——包括骨盆、腹部和胸部的轴向淋巴结病,腹部淋巴管平滑肌瘤,以及胸部和腹部乳糜液聚集——但在散发性LAM患者中(约30-40%)比在TSC-LAM患者中(10%)更常见。
LAM基因基础的发现迅速导致了雷帕霉素靶蛋白( mTOR )抑制剂的机制靶点试验,实验表明其对大多数LAM患者有稳定肺功能的作用。其他的进展包括以血管内皮生长因子D ( VEGF-D )的形式开发一种有用的诊断和预后生物标志物,为子宫来源的LAM细胞提供证据,以及制定临床实践指南。然而,在满足LAM患者需求方面仍然存在挑战,包括了解LAM的自然史、优化mTOR抑制剂的使用,以及诱导缓解疗法的发现等方面的进展。在本综述中,我们着重介绍了疾病发病机制的研究进展,包括疾病的分子机制和治疗靶点。我们描述了LAM的临床特征,讨论了目前的评估和诊断方法,并提供了一个最新的药物治疗选择和LAM管理的注意事项。最后探讨TSC-LAM和散发性LAM的自然病史和预后。
流行病学
有资料表明,散发性LAM仅限于女性。尽管10-38%的男性TSC患者在CT上可见与LAM一致的囊性变,包括一些组织学证实的病例,但症状性疾病在男性很少见。有一份报告显示,一名男子疑似散发性LAM,是由TSC嵌合现象引起。另一份报告需要进一步证实,因为遗传分析在识别TSC突变和嵌合体时的敏感性方面存在局限。据估计,每百万女性中约有3.4 – 7.8人患LAM,尽管实际患病率可能要高得多。TSC在6000例新生儿中发病率约为1,每10万人中患病率为7 ~ 12,且无性别偏倚。众所周知,TSC和LAM都没有地理或种族偏好。保守估计,全世界约有8000 - 21 000名散发性LAM患者和80 000 - 16万名TSC-LAM患者。因此,尽管TSC - LAM似乎更为常见,但在肺科门诊、登记处和临床试验中,超过80%的LAM患者均为散发型LAM。这一悖论仍未得到解释,但可能是由于散发性LAM与TSC-LAM在严重程度上的差异,或者是因为TSC的其他健康优先事项转移了TSC患者及其保健提供者对其肺部表现的关注。
病因
信号通路在LAM发病机制中的作用
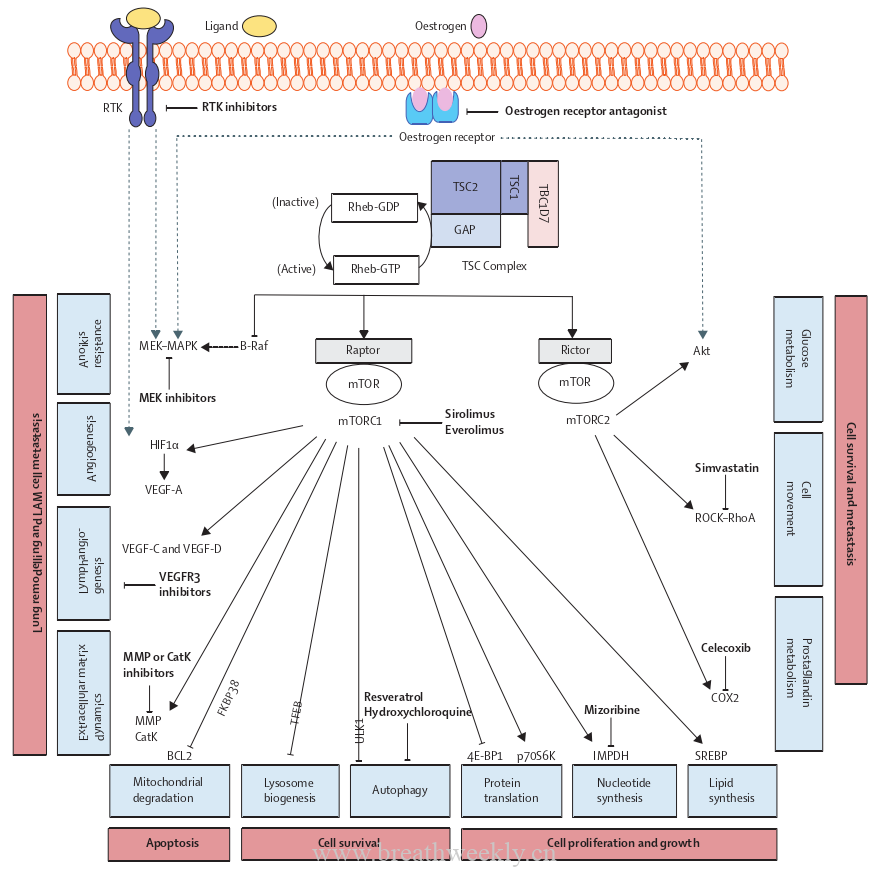
1编码hamartin,TSC2编码tuberin,tuberin与TBC1D7结合在一个复合物中,该复合物通过一个叫Rheb的中间G蛋白作为激酶mTOR的关键调节因子。完整的tuberin-hamartin复合物使Rheb以一种不活跃的、与GDP结合的形式存在(图1)。通过Akt (蛋白激酶B )磷酸化tuberin使tuberin-hamartin复合物失活,增加Rheb - GTP的丰度,促使mT OR与Raptor ( 和 mL ST8和 PRAS40 )结合形成mT ORC1复合物,并导致下游蛋白mT OR、p70S6K和4E - BP1磷酸化和活化。这些事件导致蛋白酶、HIF-1α、VEGF-A、VEGF-C、VEGF-D和IMPDH的表达增加; FKBP38 - BCL2、转录因子EB和ULK1的抑制。mT OR与Rictor ( 以及 mS IN1和 m L ST8 )结合形成mT ORC2,激活Akt ( Ser473 )、ROCK和RhoA激酶,以及环氧化酶2的表达,从而支持葡萄糖代谢、细胞存活、细胞骨架重排、细胞运动和前列腺素代谢。在TSC突变细胞中,mTORC1的高活性通过平衡、协调的方式增加蛋白质、脂质和核苷酸的合成,促进合成代谢,最终导致细胞的生长和增殖。血管生成因子VEGF - A、淋巴管生成生长因子VEGF - C和VEGF - D的表达增加,刺激LAM病灶内及周围血管生成和淋巴管通道的形成,这可能有助于LAM细胞进入循环。越来越多的证据表明,LAM细胞能够通过mT OR依赖的检查点配体的表达和自然杀伤细胞功能的调节来实现免疫逃逸。对疾病发病机制的认识提高,为LAM患者确定了许多潜在的治疗靶点(图1 )。
LAM的转移起源
已有报道,LAM在肺移植患者的同种异体移植供体中复发。病变由LAM细胞组成,这些细胞已被遗传学证明来自受体。尽管这些发现早在20年前就首先支持了这种疾病的一种转移机制,但入侵细胞的来源至今仍不清楚。由于血管平滑肌脂肪瘤含有与LAM细胞相似的遗传、形态和免疫组织化学特征的细胞,这些肿瘤被认为是潜在的原发来源;然而,并非所有LAM患者都有血管平滑肌脂肪瘤。
尽管LAM病变在子宫内也有报道,但子宫是转移的来源还是转移的另一靶点一直是争论的话题。LAM患者肺脏的单细胞RNA测序显示异位间充质细胞群,表达子宫转录程序,与子宫来源一致。通过对1例散发性LAM患者的子宫进行单核RNA测序,在一个间充质细胞亚群中发现了相同的细胞转录谱,在子宫和肺存在相同的TSC2突变,也符合一种涉及子宫转移的机制。考虑到男性LAM的发生,一定存在其他潜在的来源,而且可能会与血管周围上皮样细胞肿瘤发现的部位重叠,包括肾脏、膀胱、前列腺、胃肠道、软组织和骨骼。
性激素依赖性
LAM在所有非泌尿生殖系统肿瘤中有最强的性别偏好性。症状性LAM几乎完全限于女性,这强烈地表明女性激素在该疾病的发展和进展中起着重要作用。LAM细胞均匀表达雌激素和孕激素受体。约30 %的女性LAM患者在月经前和月经期间,肺部症状会立即加重,外源性雌激素使用和妊娠与肺功能加速下降有关。在临床前模型中,雌激素促进tuberin-null 细胞的失巢凋亡抗性、存活和肺转移,以及Eker大鼠子宫肌瘤来源的ELT3细胞和LAM患者来源的细胞中促存活激酶MAPK和Akt的磷酸化(图1 )。尽管LAM肺功能下降在绝经前妇女更为迅速,绝经后减慢,但回顾性病例系列的抗激素干预却产生了相互矛盾的结果。LAM中唯一一项抗雌激素策略的随机试验表明,芳香化酶抑制剂来曲唑对绝经后妇女是安全的,但该研究的登记人数不足,不足以解决有效性的问题。
![图片[1]-淋巴管平滑肌瘤病:发病机制、临床特点、诊断和治疗 | 每周呼吸-每周呼吸](https://breathweekly.cn/wp-content/uploads/2022/04/图1-4.png)
图1:在LAM发病机制中,信号通路的失调揭示了LAM临床试验的靶点
TBC1D7、TSC1和TSC2蛋白复合物通过TSC2上的GAP位点使GTP酶Rheb失活。Rheb抑制B - Raf导致MEK - MAPK信号失活。TSC1或TSC2突变导致激活级联反应,包括装载GTP的Rheb、包含raptor的mTORC1和p70S6K,以及上调IMPDH、SREBP、HIF-1α、VEGF-A、VEGF-C、VEGF-D、MMPs和CatK的通路;抑制4E - BP1、ULK1、TFEB和BCL2。含Rictor的mTORC2激活Akt、ROCK- RhoA和COX2。雌激素刺激MEK-MAPK和Akt活化。RTKs介导STAT和MEK-MAPK信号通路的激活。在LAM细胞中表达失调的mTOR信号会改变蓝盒所示的过程和红盒所示的细胞行为。在临床试验中研究的药物以粗体显示。4E-BP1 =真核翻译起始因子4E结合蛋白1。Akt = AKT丝氨酸-苏氨酸蛋白激酶。BCL2 = B细胞淋巴瘤2。B-Raf = V-Raf小鼠肉瘤病毒癌基因同源物B1。Catk =组织蛋白酶K . Cox2 =环氧化酶2。FKBP38 = FK506 -结合蛋白38。Gap = Gtpase -激活蛋白。HIF-1α =缺氧诱导因子1α。Impdh =肌苷5'-磷酸脱氢酶。LAM =淋巴管平滑肌瘤病。MAPK =丝裂原活化蛋白激酶。Mek = MAPK激酶。MMP =基质金属蛋白酶。mTOR =雷帕霉素作用靶点,mTORC1 = mTOR复合物1 。p70S6K = 70kDa核糖体蛋白S6激酶。Rheb =脑内富集的Ras同源物。RhoA = Ras同源家族成员A。 ROCK = Rho相关蛋白激酶。RTK =受体酪氨酸激酶。SREBP =甾醇调节元件结合蛋白。STAT =信号转换器和转录激活器。TBC1D7 = TBC1域家族成员7。TFEB =转录因子EB。TSC =结节性硬化复合体。ULK1 = Unc-51 – 样自噬激活激酶1。VEGF =血管内皮生长因子。
临床表现
自发性气胸发生在40岁或50岁的妇女,尤其是反复发作时,是LAM的典型表现。最初因进行性呼吸困难而求诊的LAM患者数量与出现气胸的患者数量相当,最初的评估往往显示胸片不明显,肺功能呈阻塞性改变。以呼吸困难为表现的患者,最初几乎总是被解释为哮喘或慢性阻塞性肺疾病,而LAM的诊断往往被推迟3 - 5年,直到由于没有加重和缓解的模式,或对常规治疗缺乏反应时才引起怀疑。大约20 %的患者以乳糜胸为主要表现,约5 %的患者出现乳糜性腹水。其他不典型表现包括咯血、因血管平滑肌脂肪瘤破裂或淋巴管平滑肌脂肪瘤扩张引起的腹痛,或痰、尿、大便或阴道分泌物中出现糜烂。LAM和血管平滑肌脂肪瘤越来越多地是由于其他目的所做影像学上偶然发现的。
无论表现形式如何,胸部CT扫描显示弥漫性、薄壁囊性变是正确诊断的关键。为明确的诊断,需要组织或细胞学证实,但临床诊断可借助CT及至少一种其他伴随特征,如TSC、血管平滑肌脂肪瘤、VEGF-D升高(≥800 pg/mL)、乳糜样积液或淋巴管平滑肌瘤。对自发性气胸患者进行胸部CT检查,以筛查潜在的囊性肺疾病,如LAM、Birt-Hogg-Dubé综合征和肺朗格汉斯细胞组织细胞增生症,已被证明是经济有效的。我们建议对育龄妇女首次发生气胸的病例进行CT筛查,对所有反复发作的气胸或自发性双侧气胸的妇女,以及对年龄≥18岁的TSC患者进行CT筛查。
血管平滑肌脂肪瘤是一种良性混合间叶性肿瘤,最常见于肾脏,但可发生于肝、肺、肠、膀胱壁和其他部位。大约30-40%的散发性LAM妇女和90%的TSC-LAM妇女会发生血管平滑肌脂肪瘤。散发性血管平滑肌脂肪瘤在普通人群中很常见,在腹部CT检查中偶然发现的发生率约为1 / 100,在转诊人群中,约12 %的患者中出现与LAM相一致的囊性肺改变。大多数肿瘤小而无症状,但大于4 cm或含有动脉瘤血管的肿瘤易出血。TSC-LAM大的、多发的、双侧肿瘤比散发性LAM更典型,而且有报道称大肿瘤患者和妊娠期的LAM生长更快,可发生慢性腹痛,血管平滑肌脂肪瘤出血可导致急腹症、危及生命的失血和死亡。 LAM患者呼吸困难的原因包括肺实质被囊肿替代、弹性回缩减少或直接累及气道导致的气道狭窄、反应性气道疾病、实质乳糜样充血、乳糜样积液或气胸。LAM中的气胸和乳糜胸通常难以保守治疗,即使在实施良好的胸膜固定术(胸膜融合术)后也可能复发。胸膜固定术失败的原因尚不清楚,但LAM细胞浸润胸膜或肺泡阻止壁胸膜表面紧密贴附可能起一定作用。LAM细胞浸润轴系和肠系膜淋巴管组织可导致淋巴结肿大、胸导管扩大和闭塞、淋巴管平滑肌瘤或大量增生不良组织( 最常发生在网膜),导致乳糜性胸腹水。乳糜性心包积液、糜烂、乳糜尿也偶见,常因空腔脏器、气道或潜在间隙之间的不典型沟通而引起。腹盆腔淋巴管疾病可引起蛋白质丢失性肠病、腹胀,腹胀有时由于重力包绕和淋巴管平滑肌瘤体积增大而在一天内恶化。
评估与诊断
诊断方法
当胸部CT发现与LAM相似的囊性病变时,无论是TSC或气胸患者的筛查发现,还是出于其他目的的扫描偶然发现,或在评估复发气胸、进行性呼吸困难时发现,或乳糜样并发症—目的是在鉴别中排除其他弥漫性囊性肺疾病,并使用尽可能微创的方法确定LAM的诊断。影像学上可以模拟LAM的疾病包括肺气肿、Birt - Hogg - Dub é综合征、滤泡性毛细支气管炎或淋巴细胞间质性肺炎、淀粉样变、轻链沉积症和肺朗格汉斯细胞组织细胞增生症。尽管胸部CT通常不足以明确区分这些疾病,但囊肿的影像学特征——包括分布、壁厚、内部结构以及与其他结构的关系——可以提供有用的线索。实验室评估应包括检测以排除以下情况:α1 -抗胰蛋白酶缺乏,可使患者易患肺气肿;结缔组织疾病,可与滤泡性毛细支气管炎或淋巴细胞间质性肺炎有关( 如类风湿因子、抗核抗体、抗 Ro、抗 La等 );以及淋巴增殖性疾病如多发性骨髓瘤( 包括血清和尿蛋白电泳及血清游离轻链 )。血清VEGF-D值大于800 pg/mL对LAM的诊断具有较高的敏感性和高度特异性。
应该考虑使用专用的腹盆CT筛查淋巴管平滑肌瘤和肾及肾外血管平滑肌脂肪瘤,因为是识别这些实体可以避免活检的需要。但在某些情况下,无法通过非侵入性方式确立明确的诊断,可能需要进行肺活检来指导治疗,特别是对于疾病负担较重的症状性患者和其他原因提示的不典型特征患者。
肺功能检测
肺功能检测对判断肺功能障碍的严重程度及指导治疗均有帮助。LAM引起肺间质平滑肌细胞的弥漫性浸润和肺实质的囊性重塑,这对弹性回缩有相反的作用。此外,气道内LAM细胞的广泛浸润导致慢性炎症、杯状细胞增生和鳞状上皮化生,所有这些都会增加气流阻力和可逆性气流阻塞。这些独特的病理特征导致了不同于间质性肺疾病的生理模式。气流阻塞是LAM最常见的生理表现,但也可能出现限制性或混合性模式。体积标记法测量肺功能时可见残余体积升高的过度充气现象,但通过气体稀释的方法并不总是这样,这表明气道和囊腔之间的交通很差,这由由超极化¹²⁹Xe MRI研究证实。大约20 - 30 %的患者存在可逆性气流阻塞,据报道与预后呈负相关。在高达90 %的患者中通常是最先出现的肺功能异常是扩散能力降低,伴随残余容积升高。
影像学评估
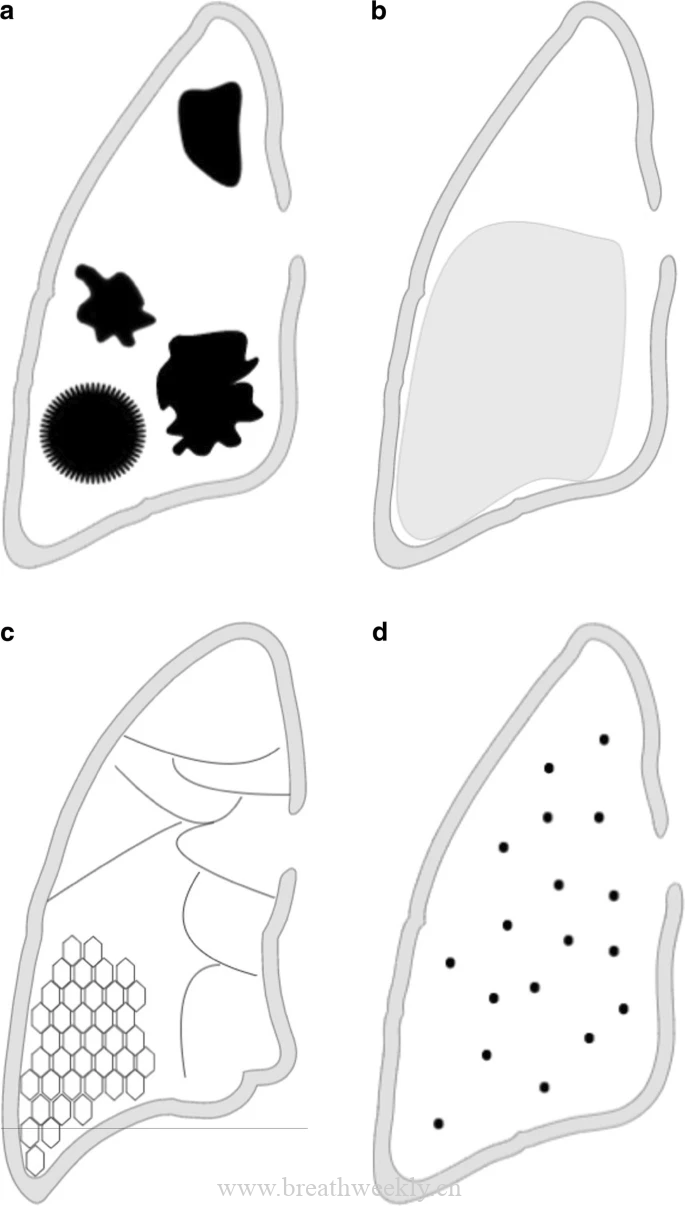
在病程早期,胸片通常正常或可能表现为间质增厚或胸腔积液。随着LAM的进展,可出现网状或结节状混浊、胸膜增厚、淋巴结肿大。在无症状患者中偶尔会发现慢性或急性气胸 (图2 )。
胸部CT上的薄壁囊肿对PLAM的诊断是必要的(图2 )。影像学上,肺囊肿被定义为与正常肺组织边界清晰的球状薄壁的光亮区或低密度。LAM囊肿薄壁,双侧,弥漫分布,圆形,大小2 ~ 30 mm,典型无内部结构。随着时间的推移,囊肿可能融合成多边形或不典型的形状。随着年龄增长可出现囊肿,因此,建议将至少4个囊肿作为考虑囊肿病理起源的阈值,并将4个或10个囊肿作为确定TSC患者LAM诊断的阈值。
胸部CT可能发现的其他影像学特征包括局灶性磨玻璃影,继发于平滑肌细胞增生、肺出血、淋巴水肿( 肺间质水肿的一种形式 )或肺泡充满淋巴液(图2 )。LAM的其他胸部淋巴表现包括间隔增厚、乳糜胸、心包积液、胸导管扩张、纵膈淋巴结肿大,以及罕见的囊性淋巴管平滑肌瘤。小叶中心结节也有报道,怀疑是平滑肌浸润和肉眼可见结节形成的表现。TSC-LAM患者可能出现由2型肺泡上皮细胞良性增生引起的多灶性小结节性肺细胞增生。
一些影像学特征有助于鉴别LAM与其他弥漫性囊性肺疾病。结节的存在、上肺优势、囊壁较厚、囊肿形状不规则、基底部相对稀疏可能提示肺朗格汉斯细胞组织细胞增生症。BHD综合征的囊肿薄壁、圆形或椭圆形,主要位于下肺,常呈纵膈旁,与胸膜和血管关系密切;而滤泡性支气管炎或淋巴细胞间质性肺炎的囊肿往往含有内部分隔,与偏心血管贴边,且大小变化较大。尽管LAM诊断的敏感性和特异性在90 %左右,但仅CT诊断特征性囊性病被认为不足以诊断LAM而使用西罗莫司的长期治疗。
![图片[2]-淋巴管平滑肌瘤病:发病机制、临床特点、诊断和治疗 | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/04/图2-5.png)
图2:LAM的影像特征:( A )胸片示右肺气胸(箭头)。( B )胸部轴位CT示散在、形态均匀的薄壁肺囊肿。( C )轴位CT胸片示弥漫性囊肿,左乳糜样胸腔积液较大,继发于淋巴水肿的小叶间隔光滑增厚(箭头所示)。 ( D )腹部和骨盆的MRI冠状面最大强度投影图像,为T2加权序列,脂肪抑制,显示显示左侧盆腔侧壁明显扩张和腹膜后淋巴管(箭头)。( E )上腹部轴位CT图像示右肾极间区出现一个大血管脂肪团(箭头),并取代了与大血管平滑肌脂肪瘤相容的腹部及腹膜后结构。( F )超极化¹ ² ⁹ Xe通气MRI图像显示肺囊肿内通气异质性(不均一性)。LAM=淋巴管平滑肌瘤病。
血清VEGF-D
2016 – 17年美国胸科学会和日本呼吸学会临床实践指南支持使用血清VEGF-D作为诊断试验,当有CT检查的女性怀疑LAM时,即使不存在TSC、血管平滑肌脂肪瘤、淋巴管平滑肌瘤或乳糜积液等其他证实性特征。CT上有特征性囊肿存在时,血清VEGF-D浓度超过800 pg / m L可区分LAM与其他囊性肺疾病的敏感性约为60 ~ 70 %,特异性近100 %。而大于600 pg / m L的敏感性为84 %,特异性为98 %。在胸部CT考虑LAM的女性中,血清VEGF-D浓度超过800pg / mL无需肺活检,浓度在600 ~ 800pg / mL之间高度怀疑LAM,低于600pg / mL的数值被认为不确定,不能排除LAM。在美国提供了商业化的VEGF-D检测,但标准化、质量控制和第三方付费者可报销的VEGF-D检测仍然是全球需要。
病理评估
是否进行活检应由医生和患者共同觉得,只有在微创措施失败,诊断的益处超过风险时才考虑。对于病情较轻的患者,定期监测可能发生的LAM的临床诊断可能就足够了,特别是如果明确诊断不会改变护理计划,而且患者对诊断的不确定性感到舒适。
尽管手术肺活检先前被认为是金标准,但经支气管肺活检的小系列报道中估计诊断率超过50 %,在某些病例中可能有用。经支气管肺活检的成功率和安全性以及经支气管冷冻活检的新技术需要进一步研究。手术肺活检的诊断率几乎为100 %,当微创方法不充分时,可能需要区分LAM、滤泡性细支气管炎或淋巴细胞间质性肺炎、肺朗格汉斯细胞组织细胞增生症以及淀粉样变或轻链沉积症。然而,手术肺活检与全身麻醉、术中气胸、术后持续性漏气和肋间神经压迫引起的慢性胸痛等风险有关。
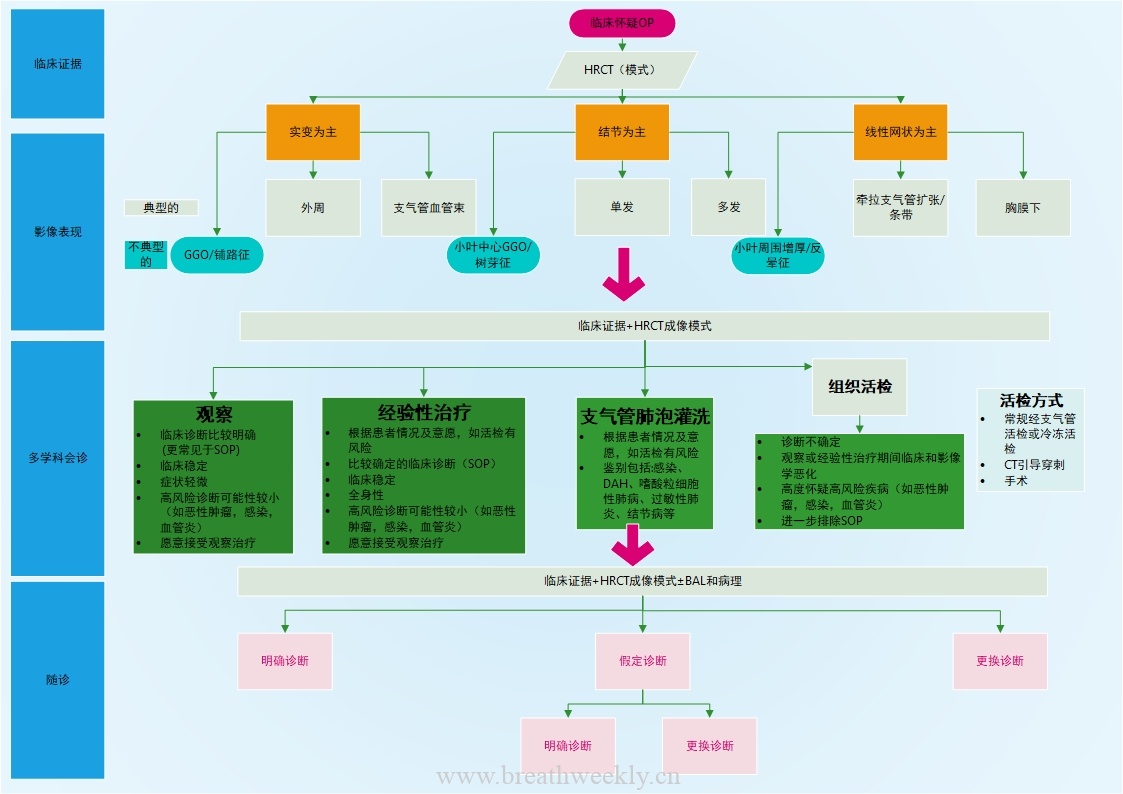
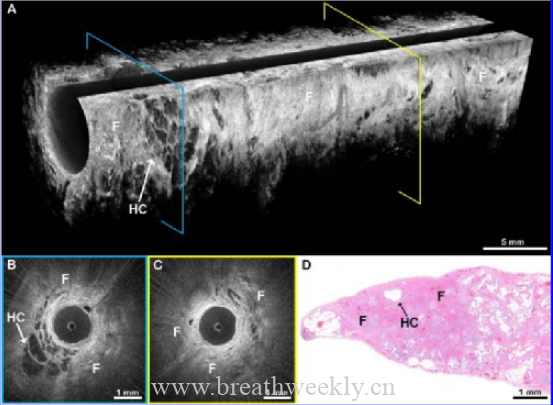
专家病理会诊是诊断LAM的重要组成部分。LAM细胞呈梭形或上皮样,线粒体少,外观淡黄。这些细胞具有可被抗体识别的平滑肌特征,包括平滑肌肌动蛋白,以及人类黑色素瘤黑素瘤 ( HMB-45 )抗体识别的前黑素细胞谱系。LAM细胞还表达雌激素受体α和β及孕激素受体。这种异常的免疫组织化学表现见于所有血管周围上皮样肿瘤,通常称为PEComas,除LAM外,还包括血管平滑肌脂肪瘤和透明细胞肿瘤。HMB-45的免疫染色在诊断上是有用的,特别是在检查小样本如经支气管活检时,尽管在极少数情况下,LAM病变不表达该标记物。随着疾病的进展,肺囊肿数目增多,LAM细胞形成特征性结节,排列在囊肿壁和小气道内。增生的2型肺泡细胞以不连续的方式内衬囊肿和周围的LAM结节。LAM结节的基质逐渐变得更加丰富和复杂,包括成纤维细胞、T细胞和肥大细胞,使得成熟的LAM病变中只有一部分细胞( 4 - 60 % )含有TSC突变。在LAM结节及其周围发现了由LYVE1、podoplanin和vegfr3阳性的淋巴内皮细胞排列的淋巴裂(图3)。结节内多种细胞类型之间的相互作用被认为有利于LAM细胞的生长和存活,以及组织损伤蛋白酶的产生。图4所示流程图,用于指导临床和胸部CT表现一致的LAM患者的诊断。LAM的管理如表所示。
![图片[3]-淋巴管平滑肌瘤病:发病机制、临床特点、诊断和治疗 | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/04/表1.jpg)
![图片[4]-淋巴管平滑肌瘤病:发病机制、临床特点、诊断和治疗 | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/04/图3-7.png)
图3:LAM的组织病理学表现: ( A ) HE染色(苏木精和伊红)肺活检显示囊性间隙,LAM结节散布于正常肺实质。( B )肺活检用α平滑肌肌动蛋白染色突出LAM结节,呈棕黄色。结节出现在肺实质内(绿色箭头),周围囊腔内(红色箭头),小淋巴管内(蓝色箭头)。( C )用PNL2单克隆抗体染色的LAM结节的高倍视野,显示LAM细胞呈颗粒状胞浆棕黄色,代表线粒体前体(绿色箭头)。( D ) LAM细胞标记物糖蛋白100 (棕黄色)和淋巴管内皮标记物podoplanin (蓝色)的双重免疫染色显示LAM结节内淋巴管内皮细胞排列的裂隙(绿色箭头)。LAM =淋巴管平滑肌瘤病。
![图片[5]-淋巴管平滑肌瘤病:发病机制、临床特点、诊断和治疗 | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/04/图4-5.png)
图4:LAM的诊断流程 方法从最少(上)到最多(下)侵入性。*包括TSC和癫痫或认知障碍的详细家族史,体格检查重点是面部血管纤维瘤、甲下纤维瘤、沙绿斑、牙斑、黑色素瘤斑、色斑病变,以及皮质发育不良、室管膜下结节和室管膜下巨细胞星形细胞瘤的影像学检查。Lam =淋巴管平滑肌瘤病。PFT =肺功能检测。TSC =结节性硬化复合体。VATS =胸腔镜手术。VEGF-D =血管内皮生长因子D。
药物治疗
mTORC1抑制剂
发现激活的mT ORC1信号通路在LAM发病中的核心作用,为mTORC1抑制剂西罗莫司(雷帕霉素)作为LAM潜在治疗方法的试验奠定了基础。在一项针对TSC或LAM患者的开放式试点研究中,使用西罗莫司12个月后,血管平滑肌脂肪瘤的体积缩小了近50 % ( n = 20 ),FEV1和用力肺活量( FVC )也有所改善,LAM患者的残余容积也有所减少( n = 11 )。这些结果导致了关键的MILES试验( NCT00414648 ),这是一项随机、双盲、安慰剂对照的3期试验,其中89名患有LAM和肺功能异常( FEV1占预计值百分比≤ 70 % )的妇女被分配( 1:1 )接受西罗莫司或安慰剂治疗12个月,然后进行12个月的观察。在12个月的治疗期间,安慰剂组FEV1以每月-12mL ( SD2mL )的速度下降,治疗组以每月1mL ( SD2mL )的速度上升 ( p < 0·001 )。与安慰剂相比,西罗莫司治疗也改善了FVC斜率和总体生活质量,降低了血清VEGF-D浓度。在观察期间,西罗莫司组FEV1下降率(下降的恢复速度)与安慰剂组相似。这些结果表明西罗莫司是一种有效的抑制LAM的治疗方法,在继续治疗的同时稳定了肺功能的下降,但停止治疗后疾病进展恢复。
西罗莫司和另一种mTORC1抑制剂依维莫司对LAM患者的有益作用已在其他多项研究中均有报道。尽管没有进行严格的研究,但是依维莫司似乎在LAM的治疗中具有与西罗莫司相似的疗效。西罗莫司也被证明有助于治疗LAM的淋巴表现,如乳糜样积液和淋巴管平滑肌瘤。关于西罗莫司治疗LAM的长期安全性和有效性的问题等待MIDAS登记处( NCT02432560 )的结果,但2014年美国国家卫生研究院(National Institutes of Health)对接受长期西罗莫司治疗的12名患者的报告显示,在5年随访期间,西罗莫司具有持久的疗效和可接受的安全性。美国胸科学会和日本呼吸学会临床实践指南推荐使用西罗莫司作为一线治疗的LAM患者,至少符合以下标准之一:FEV1占预计值的百分比≤70 %、乳糜并发症、肺功能迅速下降( FEV1下降≥ 90mL /年 )或其他表明存在重大疾病负担的指标,如弥散功能异常、空气潴留、过度充气或需要补充氧。西罗莫司被美国食品药品监督管理局、欧洲药品管理局以及日本、韩国、巴西、俄罗斯、乌拉圭等多个国家的监管机构批准用于治疗LAM。
一般来说,西罗莫司是一种耐受性良好的药物,副作用可接受。MILES试验中与西罗莫司有关的最常见的不良事件是恶心、腹泻、黏膜炎、痤疮、下肢肿胀和高脂血症。不良反应在治疗的前6个月最常见,并且随着时间的推移而减少。在MILES试验中,西罗莫司以每天2毫克的剂量开始,滴定剂量维持血药谷浓度为5 ~ 15ng / mL,平均血药谷浓度为7.2ng / mL。随后的研究表明,低剂量的西罗莫司可能具有相似的治疗效果和减少不良事件的发生率,但有一项研究发现,随着西罗莫司剂量的增加,治疗效果更好。需要进一步研究确定LAM患者的最佳西罗莫司给药策略,以最大化疗效并平衡不良事件的风险。
其他药理作用
约20 %的LAM患者可出现可逆性气流阻塞,对于有症状的患者,尤其是肺活量测量中有阻塞性缺损者,应考虑使用支气管舒张剂进行治疗性试验。多西环素对几种基质金属蛋白酶有活性,据2006年的一份病例报告,多西环素被认为是一种很有前途的治疗LAM的药物。然而,后续研究并未显示出有益的效果,并且不推荐在LAM中常规使用多西环素。由于LAM以女性为主、绝经后肺功能下降缓慢,以及有报道称疾病因补充外源性雌激素而恶化,选择性雌激素受体调节剂、孕调节剂、孕酮、芳香化酶抑制剂、促性腺激素释放激素激动剂等激素治疗药物,以及卵巢切除等外科手术已被尝试作为LAM的潜在治疗方法,但结果不一致且往往不确定。目前,抗雌激素治疗不推荐在临床试验之外进行,尽管进一步的研究包括mTORC1抑制剂和抗雌激素药物的联合治疗是必要的。但关于他汀类药物、羟氯喹和塞来昔布在LAM中的早期研究已经发表,还需要更大规模的研究来确定其临床疗效。来自细胞和动物模型的令人兴奋的新数据表明,免疫检查点抑制剂以及嘌呤和嘧啶核苷酸序列分析可能有诱导LAM细胞死亡的潜力。
自发性气胸
LAM患者应了解气胸的症状和体征,并建议症状出现时及时就医。鉴于保守治疗后气胸复发率较高,建议在自发性气胸首次发作时进行胸膜固定术(胸膜融合术),而不是在复发时。胸膜固定术可以将保守治疗的70%的复发风险降低到30%左右。电视辅助胸腔镜手术引导下的机械磨损通常是初次胸膜固定术的首选方法,化学胸膜固定术使用滑石粉等药物用于复发或难治性发作。另一种已成功用于预防复发性气胸的技术是全胸膜覆盖,其中内脏胸膜表面用生物可吸收网片加强。然而,这项技术目前只在日本的某些中心提供,需要专门的技术专长,限制了它的普遍应用。尽管尚未进行严格的研究,但西罗莫司的治疗可能有助于降低复发性气胸的风险。值得注意的是,由于西罗莫司会延迟伤口愈合,因此在气胸消退后停药2-4周再使用西罗莫司可能是谨慎的做法。与航空旅行有关的大气压变化可能引起肺囊肿扩张,并导致LAM患者出现自发性气胸,据估计每100次飞行有1到2次发作的风险。尽管患者应该被告知这种风险和在飞行中可能需要补充氧气,但大多数LAM临床医生并不建议限制空中旅行。
淋巴受累
LAM患者最常见的淋巴并发症包括:淋巴管病变;盆腔、腹部或纵膈淋巴管平滑肌瘤;还有胸腔或腹膜腔的乳糜液。可能需要引流术来证实初次出现时液体的乳糜性质,或从大量积液中缓解呼吸困难;但考虑到囊性淋巴管平滑肌瘤有诱发慢性渗漏的危险,一般不应活检、引流或切除。西罗莫司被证明能有效减少乳糜堆积,是LAM乳糜并发症首选的一线治疗方案而非侵入性手术。特别值得注意的是,在一些患者中,西罗莫司可能需要几个月才能有效治疗乳糜症状。对于复发或难治性病例,应保守选择胸导管栓塞等侵入性治疗,并且只有通过专门的淋巴管成像技术查明泄漏的来源时才能考虑。
妊娠和LAM
LAM患者妊娠与加速疾病进展和增加自发性气胸的发生率有关。也有报道称发生了没有意外的妊娠。在一项涉及有孕前和孕后肺功能数据的LAM孕妇的分析中,注意到大多数患者在怀孕期间和之后,FEV1和肺一氧化碳(DLCO)弥散能力下降速度加快。三分之一的患者( 16人中5人)在孕期出现自发性气胸。对正在考虑怀孕的LAM患者应咨询潜在的风险,这部分风险取决于母亲的肺储备。虽然西罗莫司不具有致畸性,但在动物模型中,西罗莫司与宫内胎儿死亡有关,并随母乳排出。在进行肾移植的患者和至少1例LAM患者中,在整个孕期安全使用西罗莫司已有报道;然而,西罗莫司对母婴的长期安全性和有效性还需要进一步研究。
肺移植:
肺移植是LAM和终末期疾病患者可行的管理方案。肺移植后的结果与其他慢性肺部疾病件下移植后的结果相似或优于移植后的结果。在2019年的一项分析中,Khawar和同事评估了2003年至2017年间在美国进行肺移植的LAM患者的预后,并报告了显著的12年移植后中位生存期,1年生存率94 %,5年生存率73 %,10年生存率55 %。既往胸膜固定术不是肺转移的禁忌证。在肺移植术后立即使用西罗莫司与支气管吻合口裂开的风险增加有关。然而,移植前过早停用西罗莫司可使患者出现肺功能急剧下降的危险。鉴于大多数支气管裂开发生在移植后4 - 6周,在西罗莫司停药( < 1周)后,一些中心采取了持续西罗莫司至手术当天的策略,或者在等候名单上改用半衰期更短的mTORC1抑制剂,如依维莫司。
预后
LAM是一种渐进性疾病,虽然这些数据是在常规使用mTORC1抑制剂治疗之前收集的,但据估计,超过一半的患者在症状发作10年后出现MRC3级呼吸困难( 当在水平面上行走时 )。LAM患者FEV1下降率是可变( 每年 47 - 134毫升 )。对美国国家心脏、肺脏和血液研究所( NHLBI ) LAM登记处登记的230例LAM患者进行前瞻性纵向分析,FEV1平均下降率为每年89mL ( SD 53mL )。
绝经前患有LAM的妇女FEV1下降速度比绝经后妇女快。在一项来自MILES试验的安慰剂队列的事后分析中,绝经前妇女FEV1下降速度比绝经后妇女快约5倍( 200毫升/年 vs 40毫升/年 ; p = 0·003 )。同样,NHLBI队列中,FEV1下降速度在绝经后女性比绝经前女性低44 m L /年( 74毫升 /年 vs 118毫升 /年 ; p = 0·003 )。
基线血清VEGF-D浓度升高在一些研究中与疾病进展较快有关,而在另一些研究中则没有。同样,对支气管舒张剂的积极反应也与疾病进展较快有关,尽管在MILES试验中未见这种关联。无论是基线FEV1,还是自发性气胸的存在或数量,似乎都对未来FEV1的下降率没有显著影响。
LAM患者的中位生存期估计在确诊后20年以上,5年的无移植生存率为94 %,10年为85 %,15年为75 %,20年为64 %。总的来说,与早期的报告相比,这些估计代表了预后的整体改善,可能是由于在病程早期对LAM的认识和鉴别的增加。绝经前状态、基线肺功能异常( FEV1和DLCO )、较低的FEV1∶FVC比值、出现呼吸困难(相对于气胸)、较差的组织学评分、需要补充氧气等均与LAM患者的低生存率有关。
虽然TSC-LAM被认为是一种比散发性LAM更轻的肺部疾病,但对TSC的青壮年女性进行指导筛查可以识别早期疾病,这可能导致确定偏倚。在TSC - LAM与散发性LAM患者疾病严重程度相匹配的NHLBI队列研究中,两组患者FEV1下降率相似。通过对MILES试验参与者和一个附带诊断LAM的巴西队列患者的事后分析也得出了类似的结论,这种方法并没有因为筛查带来的选择偏差而混淆。LAM可能是TSC患者死亡的主要原因;在一个大型TSC三级护理转诊中心的回顾性分析中,LAM被报道为成人总体第二大常见的死因,也是TSC成年女性的主要死因。西罗莫司对总生存率和肺移植进展的可能性的影响尚不清楚。
结论
理解和管理方面的迅速进展以及LAM结果的改善,在一定程度上可归因于患者的远见卓识,他们以促进研究和临床试验的方式进行合作。研究人员和患者在科学会议上的密切互动、支持试点研究的基层筹资以及在多个中心分发专门知识是取得进展的关键。从TSC和LAM中mT OR通路的研究中吸取的经验教训使我们对细胞代谢的认识取得了根本性进展,并促使人们对mT OR抑制剂在其他肺部疾病中的应用产生兴趣,如结节病、弥漫性特发性神经内分泌细胞增生、Castleman病和COVID-19。未来的研究目标包括建立更准确地再现人类疾病的LAM细胞和动物模型,了解免疫系统在LAM发病机制和治疗中的作用,并进一步明确mT ORC1的激活如何促进细胞生长和转移。LAM治疗发展的下一步是改进mTORC1抑制剂的使用方法,包括最佳剂量和细胞溶解联合疗法;利用对疾病机制的理解,发展更有力的诊断、预后和预测生物标志物;并为诱导缓解治疗的发展探索新的试验设计方法。
欢迎关注每周呼吸公众号及小程序
![图片[6]-淋巴管平滑肌瘤病:发病机制、临床特点、诊断和治疗 | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/04/weixinfenxianghaibao-1.png)
![图片[7]-淋巴管平滑肌瘤病:发病机制、临床特点、诊断和治疗 | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/04/gh_b2fa4b0d7ccf_258-2.jpg)
[download id="3957"]
水平有限,如有错误请及时指出,感谢!









暂无评论内容