(Sridhar S, Kanne JP, Henry TS, Revels JW,Gotway MB, Ketai LH. Medication-induced Pulmonary Injury: A Scenario- andPattern-based Approach to a Perplexing Problem. Radiographics. 2022Jan-Feb;42(1):38-55. doi: 10.1148/rg.210146. Epub 2021 Nov 26. PMID: 34826256.公众号回复“药物相关”或登录网站可下载原文)
简介:
随着药品许可的加速,放射科医生面临着药物诱导肺损伤识别的新挑战 (MIPI)。药物诱导的肺损伤可以包括药物性间质性肺病 (DILD) ,药物引起的肺毒性反应。许多与MIPI相关的新的药物与抗癌或生物制剂(药物来自生物体成分) 有关; 这些新的许可药物治疗超过了抗生素和心血管药物治疗3倍。MIPI可以由许多机制引起肺损伤,包括直接的DNA损伤,增强细胞凋亡或抑制细胞增殖的肺泡细胞信号通路的改变,以及 T细胞介导的免疫损伤。在某些情况下,肺损伤是多因素的。
MIPI的发病率在每年百万分之4.1到12.4之间。某些类别的药物与较高的 MIPI 发生率相关(表 1)。MIPI 的典型病因包括胺碘酮、甲氨蝶呤和博来霉素,患病率分别为 1.2%–8.8%、0.06%–15% 和 6.8%–15% 。具有代表性的检查点抑制剂纳武单抗(见肿瘤学部分)与 11.8% 的 MIPI 患病率相关。尽管与大多数药物相关的 MIPI 的患病率很低,但从某些药物中发展为临床MIPI 的患者死亡率很高。这些包括博来霉素、厄洛替尼和帕尼单抗,死亡率分别为8.1%–23%、31%–45% 和 51.2%。
![图片[1]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/表1.jpg)
几个因素可能会增加多种药物类别间MIPI的风险。这些包括年龄增加、既往间质性肺病、吸烟史、药物相互作用和男性。对于某些药物,如胺碘酮,肺毒性作用是剂量依赖和累积的。
MIPI 的诊断很困难,通常取决于用药时间与肺部疾病发作的时间相关性、排除其他诊断以及停药后症状和影像学缓解。通过识别在特定临床环境中通常使用哪些药物,以及与这些药物相关的典型成像模式,可以帮助诊断。
本综述的目的是提供一个根据临床情况辅助诊断 MIPI教学框架,并将这些与 MIPI 的特定 CT 模式相关联(表2)。由于许多药物可以产生多种肺损伤模式,但贪多无益,我们主要专注于特定药物或药物类别的最常见模式。
表2 根据临床疾病诊断MIPI
![图片[2]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/表2-1024x672.jpg)
临床诊断与管理
由于症状与开始用药的时间关联,通常怀疑 MIPI。在检查点抑制剂的情况下,中位延迟约为 3 个月,但在大多数药物中,从开始治疗到发生肺炎之间的持续时间尚不明确。该持续时间可能因患者与使用相同药物治疗的患者而有很大差异。例如,虽然检查点抑制剂 MIPI 发病的中位时间约为 3 个月,但范围从 9 天到 19 个月。一些标准药物(如博来霉素和环磷酰胺)的毒性作用是剂量依赖性的,并且疾病可以在开始治疗数年后出现。
患者的表现可以从无症状的无法解释的影像表现到到有呼吸困难、咳嗽、喘息和发烧的严重症状。美国国家癌症研究所不良事件通用标准 (NCI CTCAE) 提供了一个分类系统,用于对“肺炎”或 MIPI 的严重程度进行分层。这种命名法的范围从无症状(1 级,仅放射学异常)到致命(5 级),是基于患者的机能和临床表现。
最近的一项研究提出了一种评分系统,以美国胸科学会(ATS) -欧洲呼吸学会(ERS)药物诱导间质性肺疾病(DILD)模式和受累性肺体积为基础,在CT上评估MIPI的严重程度。这个研究表明 DILD 评分与 NCI CTCAE 临床严重程度分类呈正相关。此外,症状的严重程度与 MIPI 的影像模式相关。与具有非特异性间质性肺炎 (NSIP) 模式的患者相比,具有机化性肺炎 (OP) 表现的患者或者在更大程度上具有过敏性肺炎表现(以小叶中心GGN为主)的患者症状较轻。弥漫性肺泡损伤 (DAD) 患者可能表现为弥漫性磨玻璃影 (GGO)(见 CT 模式部分),症状更严重。
MIPI 的评估包括排除可以解释患者症状的其他诊断。如果要考虑流体静力性肺水肿,可以检测BNP或心脏彩超。前者的低值(<100 pg/mL [11.8 pmol/L])对心力衰竭有很高的阴性预测值,而中间值(100-400 pg/mL [11.8-47.3 pmol/L])非特异性。辅助检查(表3)还包括支气管肺泡灌洗 (BAL),主要用于排除感染、恶性肿瘤或肺出血。在少数情况下,BAL 液中的嗜酸性粒细胞增多或淋巴细胞增多可支持 MIPI 的诊断。缺乏确认MIPI存在的特殊实验室检查,但在某些情况下,辅助药物诱导的白细胞刺激测试和白细胞迁移测试可能支持诊断。
表3 BAL在MIPI中的作用
![图片[3]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/表3-1024x411.jpg)
使用2mm层厚或更薄切片和多平面重建的常规胸部 CT 足以评估可能的 MIPI,并且可以在没有强化的情况下进行。如果临床关注原因不明的间质性肺病,需要包括呼气相检查,但对于 MIPI不是必需的。放射科医生可以通过报告患者接触过的药物中通常与 MIPI 相关的成像模式来帮助诊断,例如,“观察到的 OP样改变可能与药物反应有关。”特定的成像方式可以帮助与其他疾病鉴别。例如,与 MIPI 相比,广泛的树芽征可能代表感染或误吸。
如果 MIPI 是基于与药物治疗相关的临床症状和影像学异常的时间,一般会停用药物。在仅具有 MIPI 影像表现而无症状患者中,已报告使用特定药物继续对患者治疗至关重要的药物,例如新型酪氨酸激酶抑制剂 (TKI)。在其他情况下,如果 CT表现通常对类固醇有反应,例如小叶中心 GGN 或 OP,则可以开始激素治疗。在许多情况下,对患者目前存在疾病的治疗需要更换治疗方案。具有相似作用机制的药物往往会导致相似的影像表现。然而,与既往有过敏反应或过敏反应的患者相比,MIPI患者在使用同一药物类别的药物时,发生复发性疾病的可能性较小。
病理生理学
MIPI 的原因尚不完全清楚,特定药物优先损伤肺部而不是其他组织的机制也不清楚。一些药物可能在肺中达到更高的浓度,而另一些药物可能在肺中发生生物活性改变而变成有毒代谢物。不同药剂的毒性机制差异很大。例如,博莱霉素引起的肺损伤的机制可能包括由肺中高氧含量引起活性氧增加从而引起DNA损伤。
存在许多其他肺损伤机制,大多数在药物剂量和 MIPI 发展之间没有明确的关系。这些损伤机制是多种多样的。例如,TKIs抑制肺泡上皮细胞增生。利妥昔单抗(一种针对 CD20 淋巴细胞表面抗原的单克隆抗体)触发补体级联反应、B 细胞裂解和细胞因子释放,例如肿瘤坏死因子(TNF-α)。
检查点抑制剂的抗肿瘤机制是基于认识到 T 细胞、树突细胞和巨噬细胞上表达的抑制性受体和配体是肿瘤免疫抑制的关键介质。这些抑制性受体还调节生理免疫反应,以维持自身耐受性并最大限度地减少由过度组织炎症引起的组织损伤。这些抑制剂的阻断导致免疫系统的复杂改变,这可以表现为具有本文所述的各种影像表现的 MIPI。
CT表现形式
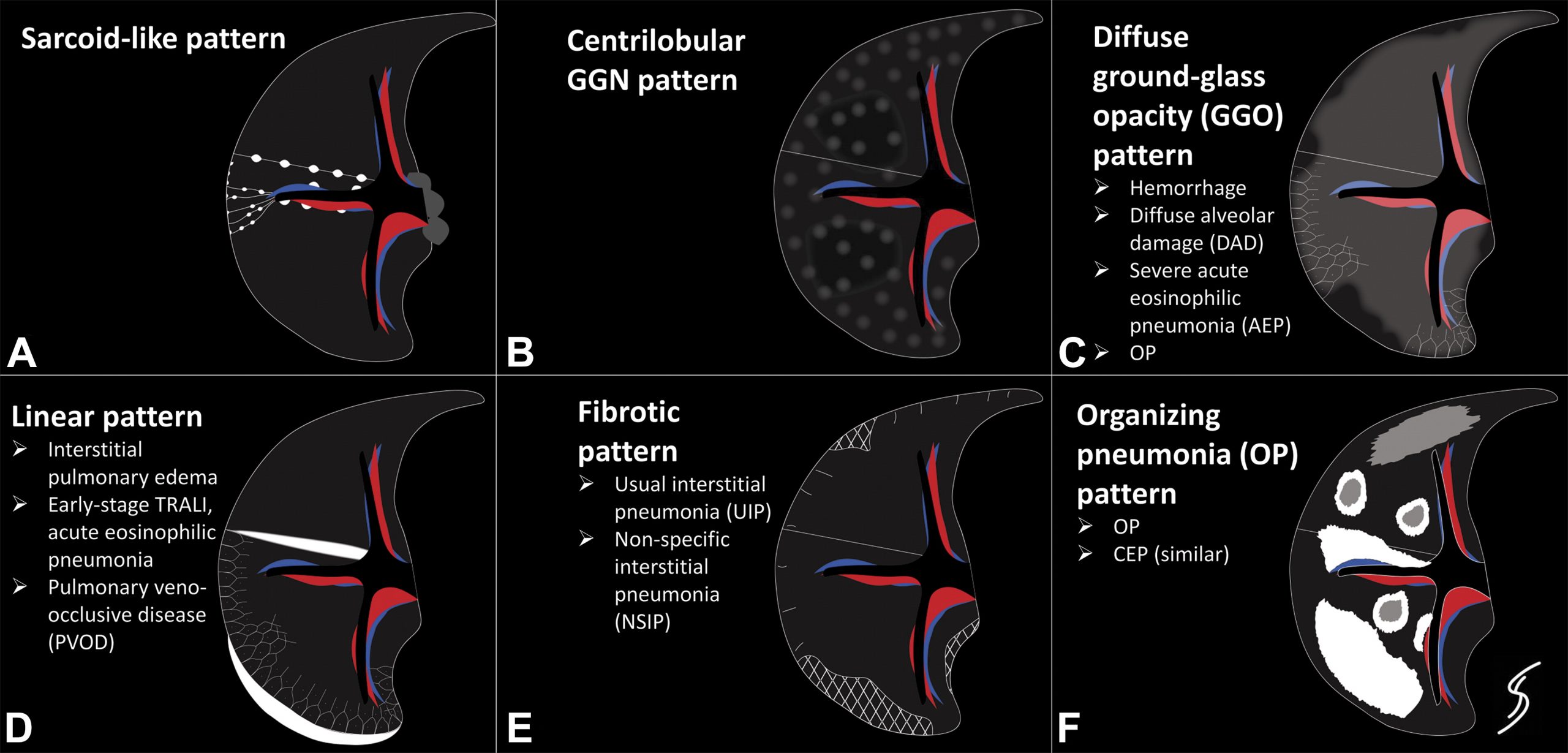
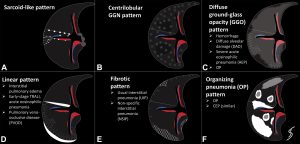
MIPI影像表现可以概括为六种CT形式:类结节病、小叶中心GGN、弥漫性GGO、索条样间隔、纤维化和OP。
这些模式代表了有用的常见形式。但是,影像模式可能会重叠;例如,一些 OP表现的MIPI 的毛玻璃成分可以足够广泛,以至于外观也可以被认为是弥漫性的GGO。在其他情况下,模式可以从一种转变为另一种,这取决于损伤的严重程度和时间演变。然而,这些模式作为一个有用的框架来帮助区分一系列令人眼花缭乱的潜在MIPI。
在特发性和药物引起的结节病中,非干酪样肉芽肿沿着支气管血管周围和胸膜下间质以及小叶间隔的淋巴管分布。这在 CT 上表现为淋巴管周结节(图 1A)。支气管周围和纵膈淋巴结病也很常见,或与淋巴管周结节有关,或作为一个单独的发现。
![图片[4]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图1-1-1024x492.jpeg)
小叶中心GGN模式在文献中通常被称为“HP”样MIPI(图 1B )。CT图像显示小叶中心 GGN,有时伴有小叶空气潴留。然而,过敏性肺炎是对吸入有机抗原的免疫反应,可导致细胞性细支气管炎和细支气管周围的间质性淋巴细胞性肺炎。这种对全身用药反应的影像模式的病理生理学基础尚不清楚,但可能与真正的过敏性肺炎不同。潜在的病变可能代表以细支气管为中心的OP,例如与电子烟或电子烟相关肺损伤。或者,小叶中心形式可能是滤泡性细支气管炎对全身用药的反应,而不是吸入抗原的反应。
弥漫性 GGO 模式(图 1C)通常与 DAD 相关,通常涉及肺泡壁所有成分的损伤。CT 表现包括弥漫性GGO,通常伴有片状实变。一般而言,在 DAD 中,实变和 GGO 表现出重力依赖性梯度,由于水肿性肺实质中的肺泡塌陷,肺后部明显。还可以看到弥漫的“铺路征”表现。随着机化和纤维化,网状和牵引性支气管扩张可能发展,肺前部明显。
OP可引起弥漫性GGO,但稍后描述的分布在支气管血管周围分布或胸膜下的OP改变经常持续存在。弥漫性肺泡出血较少见,可引起弥漫性GGO。它更容易引起斑片状GGO或GGO合并中央分布的实变,而不像DAD中常见重力效应所致实变。
条索样分隔由平滑的间隔增厚组成,有时伴有胸腔积液(图 1D)。这种模式最常由静水性肺水肿引起的淋巴充血引起,是 MIPI 的一种罕见表现。然而,这种模式可能发生在没有 DAD 的弥漫性毛细血管渗出的情况下。
纤维化样改变是由肺泡壁和沿着小叶间隔和小叶内间质延伸的支撑结构损伤引起的(图 1E)。最常见的表现是NSIP模式,其中存在由胶原和单核炎性细胞浸润引起的均匀肺泡壁增厚。影像学表现包括网状结构、牵拉性支气管扩张,以及在某些情况下支气管血管周围增厚)。MIPI 的纤维化模式较少表现为常见的间质性肺炎 (UIP)(图2)。
![图片[5]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图2-1024x353.jpg)
OP 模式(图 1F)是由细支气管和肺泡损伤引起的,肉芽组织在终末气道中形成并延伸到肺泡腔内。最常见的急性表现包括多灶性双侧支气管血管周围或外周 GGO 或实变。结节、拱形或多边形斑片影,比小叶间隔更厚且界限更差(小叶周围斑片影),以及 GGO 的局灶区域伴有实变边缘(环礁或反向晕征)也是常见的发现。CT 表现与药物引起的慢性嗜酸性粒细胞性肺炎(CEP)重叠。CEP 在临床上与急性嗜酸性粒细胞性肺炎和单纯性嗜酸性粒细胞性肺炎的区别在于其影像表现和症状持续一个月或更长时间。
在临床实践中应用这些成像模式是有细微差别的,因为大多数药物可以表现出不止一种模式。许多药物均可能导致弥漫性GGO和OP模式,这可能反映了对肺泡上皮基底膜的损害是OP和DAD的共同组成部分。此外,一些药物造成的损伤最初可能局限于内皮,导致毛细血管渗出,但后来会进展到整个肺泡壁。即使成像模式与特定药物的最常见表现相匹配,损伤仍可能是由 MIPI 以外的疾病引起的(表 4)。
表4 MIPI表现的非药物相关的疾病
![图片[6]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/表4.jpg)
虽然前面描述的六种成像模式涵盖了绝大多数 MIPI,但一些药物表现出具有独特模式的 MIPI。例如,在类风湿性关节炎的情况下,来氟米特给药可能与多个类风湿结节的发展有关。
临床场景
在考虑 MIPI 的诊断时,确定照顾患者的科室以及检查的原因可能是一个有用的出发点。这可以提示患者可能接触到的特定药物以及鉴别诊断范围。例如,结缔组织病相关的间质性肺病(CTD-ILD)可能出现在风湿病科,肺水肿出现在心脏病科,感染出现在血液科和肿瘤科。
科室:风湿病学或胃肠病学
风湿性疾病的治疗方案从非甾体抗炎药 (NSAID) 开始,必要时添加非生物改善病情的抗风湿药 (DMARD),例如甲氨蝶呤、来氟米特、硫唑嘌呤和羟氯喹(表 2)。二线药物包括生物 DMARD,可抑制肿瘤坏死因子-1 (TNF-α) 和各种白细胞介素促炎细胞因子介导的级联反应。
患有炎症性肠病的胃肠病临床患者也可以接受 DMARDs(包括硫唑嘌呤和甲氨蝶呤)和生物 DMARDs(包括 TNF-α 抑制剂、英夫利昔单抗和阿达木单抗)治疗。此外,病毒性肝炎患者可以使用另一种免疫调节剂干扰素-α进行治疗。
特定肺部疾病注意事项
在出现肺部症状的风湿病临床患者中,最初的考虑因素通常包括 CTD-ILD 和感染(由于 DMARD 的免疫抑制)。特别是, 在没有预防措施的情况下,这些患者可能会发生肺孢子虫肺炎。接受免疫抑制治疗的炎症性肠病患者也有感染风险。炎症性肠病中潜在的弥漫性肺病并不常见(OP已被报告)。
已经在使用甲氨蝶呤和其他 DMARD 治疗的患者中描述了 MIPI 的纤维化模式(图 3)。当CT 模式与NSIP一致时,它与 CTD-ILD 无法区分,并且区分通常依赖于与药物治疗的时间相关性。存在常见的间质性肺炎表现,而不是NSIP形式,有利于CTD-ILD 而不是 MIPI是纤维化的原因。在其他甲氨蝶呤引起的肺损伤病例中,主要发现是 GGO 而不是网状结构,整体外观最符合OP 模式(图 4 )。甲氨蝶呤偶尔会出现小叶中心模式,这可能代表支气管周围OP。暴露于硫唑嘌呤和 6-巯基嘌呤(图5 )时,也报告了典型的 OP 模式和小叶中心结节模式。
![图片[7]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图3.jpg)
图 3.一名 56 岁的类风湿性关节炎女性在开始甲氨蝶呤治疗后几个月出现新的呼吸急促,甲氨蝶呤诱导的 MIPI。轴向平扫 CT 图像显示 MIPI 的纤维化模式,包括斑片状双侧外周和间隔增厚和 GGO,可能有小的蜂窝状病灶。与甲氨蝶呤治疗和症状的时间关联提示 MIPI,但单独的成像模式与 CTD-ILD 无法区分。
![图片[8]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图4.jpg)
图 4.一名 62 岁的类风湿性关节炎女性在近期开始甲氨蝶呤治疗后出现呼吸急促,甲氨蝶呤诱导的 MIPI。CT显示弥漫的的双侧 GGO,外周不受影响,可能有小叶周围混浊。这可以描述为弥漫性GGO 或 OP 模式。除了活检之外,对类固醇的临床反应可以帮助鉴别。
![图片[9]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图5-1.jpg)
图 5. 42 岁溃疡性结肠炎女性患者 6-巯基嘌呤诱导的 MIPI,她在开始 6-巯基嘌呤治疗后出现呼吸急促。横断面 (B) CT 图像显示 MIPI 的小叶中心 GGN 模式,有许多细微的小叶中心 GGN(B 中的箭头),胸膜下不受影响。
在风湿病和胃肠病科室的患者中,结节病样 MIPI 比其他环境中更常见,但接受免疫治疗的肿瘤患者除外。这可能与他们用免疫调节剂治疗有关,特别是 TNF-α 抑制剂。例如,TNF-α抑制剂阿达木单抗可引起结节样反应(图6)。还报道了阿达木单抗诱导的弥漫性 GGO 和其他 MIPI 模式的孤立病例(图7)。其他免疫调节药物如 IFN-α 也可产生类结节样表现(图 8)。
![图片[10]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图6.jpg)
图 6.一名 61 岁克罗恩病男性患者在开始使用 TNF-α 抑制剂阿达木单抗治疗后出现咳嗽,阿达木单抗诱导的 MIPI。(B)轴位 CT 图像显示 MIPI 的结节病样模式,包括双侧淋巴结节(箭头)。
![图片[11]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图7-1.jpg)
图 7.一名 65 岁类风湿性关节炎男性在阿达木单抗治疗期间接受 CT 检查时,阿达木单抗诱导的 MIPI。横断面 MIPI 的弥漫性 GGO 模式与胸膜下未受累(箭头)。这种外观可能代表早期 DAD 或 OP 的表现。
![图片[12]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图8.jpg)
图 8.一名正在接受 IFN-α 治疗的 42 岁肝炎患者的 IFN-α 诱导MIPI。冠状位 CT 图像显示 MIPI 的结节病样模式,包括沿叶间裂和脏层胸膜表面(黑色箭头)的微结节。
心内科
在心血管疾病的情况下,肺部疾病的鉴别诊断通常包括肺水肿的表现。MIPI 在接受心血管疾病治疗的患者中并不常见,但在临床特征、BNP水平和心脏彩超检查结果表明不太可能出现肺水肿的患者中,MIPI 可能是一种潜在诊断。通过引起弥漫性 GGO,MIPI 的条索样间隔模式或两者的组合来识别可以模仿水肿的药物是有用的。
抗凝剂或溶栓剂引起的弥漫性肺出血并不常见,但可引起弥漫性 GGO,类似于肺水肿(图 9)。可能存在小叶间隔增厚,但直到急性出血后 48-72 小时才会出现。
![图片[13]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图9.jpg)
急性嗜酸性粒细胞性肺炎 (AEP) 可表现为不同程度的条索样间隔和弥漫性 GGO 模式,类似于肺水肿。AEP 通常与吸烟有关,但也与多种药物有关,包括抗心律失常药胺碘酮和美西律。不像吸烟那样通过上皮损伤募集嗜酸性粒细胞,药物可能会损害内皮细胞。随后释放的嗜酸性颗粒导致蛋白质渗出。
早期或轻度 AEP 表现为条索样间隔模式,间隔明显增厚和不同数量的 GGO。在早期阶段,外周血中可能不存在嗜酸性粒细胞,仅在支气管肺泡灌洗液中存在。在更严重的 AEP 病例中,双侧 GGO 和实变可以主导 CT 表现,提示进展为 DAD(图10)。
![图片[14]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图10.jpg)
图 10.在美西律治疗期间出现 AEP。轴向 CT 图像显示 MIPI 的弥漫性GGO 表现,包括重力效应实变和弥漫性 GGO,提示发展为DAD。间隔增厚(箭头)很明显(与 GGO 结合形成铺路征)。
在用于治疗心血管疾病的药物中,胺碘酮是最常见的 MIPI 来源,并且可能表现为多形性影像学表现。胺碘酮在肺部以高浓度蓄积,但尚不确定是直接毒性作用还是继发性免疫反应是造成肺部损伤的原因。胺碘酮可通过引起 DAD 表现出弥漫性 GGO 模式,尽管这种情况相对罕见 (图 11 )。这种表现与心血管手术后患者的显着死亡率相关。
![图片[15]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图11.jpg)
图 11.一名 73 岁女性在开始胺碘酮治疗后出现呼吸急促,胺碘酮诱导的 MIPI。CT 图像显示 MIPI 的弥漫性 GGO 模式。依赖性肺实质的较高密度与 DAD 一致。支气管扩张(箭头)表明进展到机化阶段。
接受长期胺碘酮治疗的患者更常出现 OP 和 MIPI 的纤维化模式(图12A)。由胺碘酮沉积引起的高密度区纤维化型 MIPI 患者中通常难以辨别,但在 OP 型实变病灶内更为明显(图 12B )。在接受胺碘酮治疗的患者中,在非增强 CT 上的高密度肺实质常见于肺不张区域。这可能代表碘的组织沉积,类似于在肝脏和甲状腺中看到的,但可能不代表无症状患者中胺碘酮诱导的 MIPI(图 12C)。
![图片[16]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图12.jpg)
图 12.接受胺碘酮治疗的患者肺部斑片影。(A,B)一名 78 岁男性右下叶的轴向 CT 图像(A,肺窗;B ,纵隔窗)显示 GGO 和网状实变,提示 OP 和轻度纤维化。周围实变( B中的箭头)在纵隔窗图像上具有密度。(C)一名接受胺碘酮治疗的 79 岁女性的轴向 CT 图像显示被动肺不张的高密度肺实质(箭头)。胺碘酮诱导的碘沉积导致的高密度肺实质本身并不代表 MIPI。
血液科
血液疾病包括血细胞合成、功能或增殖的障碍。大多数与 MIPI 相关的药物用于治疗血液系统恶性肿瘤(表 2)。血液系统恶性肿瘤的细胞学特征决定了治疗方法。
例如,治疗急性髓细胞性白血病 (AML) 和急性早幼粒细胞性白血病 (APML) 的第一步是通过积极的化疗诱导缓解,以实现降低细胞负荷。AML 的典型治疗包括阿糖胞苷和蒽环类药物(如柔红霉素)的组合。在 APML 的情况下,全反式维A酸(ATRA) 取代了阿糖胞苷。确认缓解后,开始巩固化疗。急性淋巴细胞白血病或淋巴瘤采用了类似的治疗模式,尽管使用了不同的药物。
慢性粒细胞白血病 (CML) 的治疗取决于疾病的阶段。慢性稳定期采用 TKI 治疗,而加速期和急变期采用 TKI 和/或造血干细胞移植治疗。活动性慢性淋巴细胞白血病的治疗取决于疾病基因型,但可能包括环磷酰胺和利妥昔单抗。
淋巴瘤涵盖了具有不同细胞来源和临床侵袭性的异质性淋巴增殖性恶性肿瘤的集合。常见的淋巴瘤包括弥漫性大 B 细胞淋巴瘤 (DLBCL) 和霍奇金淋巴瘤。DLBCL 的治疗方案取决于细胞遗传学特征,但利妥昔单抗和环磷酰胺是最可能与肺毒性作用相关的成分。更强化的方案也可能包括博来霉素。霍奇金淋巴瘤的治疗方案通常使用博来霉素。蒽环类药物通常是霍奇金和非霍奇金淋巴瘤治疗方案的组成部分,但肺部毒性作用很少伴随着众所周知的心脏毒性作用。
血液科特定肺部疾病注意事项
由于它们的免疫抑制,正在接受血液系统恶性肿瘤治疗并出现呼吸道症状的患者最初会接受感染评估。患有严重和长期的中性粒细胞减少症的人有感染血管侵袭性真菌的风险,这可能导致晕征和反晕征。后一个表现也与 OP 相关,但在这些感染的情况下,通常不存在 OP 模式的其他典型特征。
由于积极的化疗相关水化和频繁输血,正在接受血液系统恶性肿瘤治疗的患者也有发生肺水肿的风险。在接受蒽环类药物治疗的患者中,药物引起的心功能不全可能是一个促成因素。此外,强化诱导治疗后,肺水肿可能由肿瘤溶解综合征引起的急性肾功能衰竭引起。白细胞停滞、白血病细胞肺病和高白细胞反应都可引起 DAD,并伴有相关的弥漫性 GGO 模式。
博来霉素诱导的 MIPI 可引起一系列CT 模式,最常见的是与 DAD 相关的弥漫性 GGO 模式。使用高浓度氧气会加剧这种情况(图 13)。其他模式包括纤维化和 OP 模式,它们更常见于治疗的亚急性至慢性阶段。环磷酰胺是一种烷化剂,是上述几种方案中的一种成分,是纤维化模式的不太常见的原因。
![图片[17]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图13.jpg)
用于血液系统恶性肿瘤的非细胞毒性药物可导致其他类型的 MIPI。APML 的 ATRA 治疗与分化综合征有关,发生率高达25%。该综合征可能是由于早幼粒细胞快速分化为中性粒细胞,中性粒细胞迁移到肺部,引起“炎症风暴”和弥漫性毛细血管渗出,导致发热、呼吸困难和低血压(图 14 )。相关的 MIPI 表现为轻度时呈条索样间隔,严重时表现为弥漫性 GGO 型。针对淋巴细胞分化簇 (CD) 抗原的抗体(例如利妥昔单抗)治疗淋巴瘤也可能产生毛细血管渗出综合征。
![图片[18]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图14.jpg)
用于治疗 CML 的 TKI 可导致液体潴留。此外,这些药物可引起 MIPI,表现为支气管血管周围和外周 GGO,与 OP 模式一致(图 15)
![图片[19]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图15.jpg)
图 15. 37 岁男性因 CML 接受 TKI 达沙替尼治疗,出现呼吸急促,达沙替尼诱导的 MIPI。轴向 CT 图像显示 MIPI 的 OP 模式,包括双侧支气管血管周围和胸膜下 GGO,周围小叶保留。接受 TKI 治疗的患者也经常出现与液体潴留相关的胸腔积液。
肿瘤科
实体恶性肿瘤的治疗(表 2)包括经典的抗肿瘤药物,例如干扰 DNA 复制的紫杉醇类药物和其他细胞毒性药物(稍后讨论)。TKI 也用于治疗各种实体恶性肿瘤,虽然相关 MIPI 的发生率很低(约 1%),但如果同时使用检查点抑制剂,它会增加。当确实发生毒性作用时,死亡率可高达 20%–50% 。
越来越多的靶向单克隆抗体疗法支持了实体恶性肿瘤的治疗。虽然一些药物(例如曲妥珠单抗)靶向过度表达的表面生长受体并下调增殖能力,但其他药物调节免疫系统以增强 T 淋巴细胞介导的肿瘤破坏。后一种药物统称为免疫检查点抑制剂免疫疗法。
美国食品和药物管理局 (FDA) 批准的检查点抑制剂包括靶向程序性细胞死亡-1 (PD-1) 跨膜蛋白(例如,纳武单抗)和靶向 PD-1 配体 1 (例如,atezolizumab)(PD-L1)在肿瘤细胞上。两种阻断信号都抑制 T 淋巴细胞介导的肿瘤破坏。Ipilimumab等药物阻断 CTLA-4A 受体并降低抗原呈递的阈值以诱导 T 细胞活化,从而促进肿瘤细胞凋亡。
肿瘤科特定肺部疾病注意事项
这些患者的肺部症状通常是由肿瘤复发和扩散、静脉血栓栓塞或感染引起的。感染肺孢子虫经常会导致弥漫性 GGO 模式,而血管侵袭性真菌(前面讨论过)和肺梗塞会导致反向晕征,在 OP 模式 MIPI 中也可见。肺水肿可能与曲妥珠单抗和检查点抑制剂引起的可逆性心肌病有关,但对心脏毒性作用的深入讨论超出了本综述的范围。
先前接受过肺部放射治疗的患者也可能发生“放射回忆性肺炎”。这种情况表现为放射治疗后数月至一年以上发生的局灶性 GGO 和巩固。其表现可能类似于感染,但与肺炎不同的是,斑片影通常界限分明并局限于先前的放射野。放射回忆性肺炎在使用传统细胞毒剂后被广泛报道。最近,它还与 TKI 和免疫调节剂治疗有关,其机制尚不清楚(图 16)。
![图片[20]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图16.jpg)
经典的细胞毒药物如紫杉烷、长春碱类、铂类和抗代谢物(如吉西他滨)用于治疗常见的实体恶性肿瘤,包括乳腺癌、卵巢癌和肺癌。与博来霉素一样,这些药物中的许多都与急性或亚急性弥漫性 GGO 模式和几个月内发展的更慢性的纤维化模式有关。吉西他滨还可引起与 相关的更严重的毛细血管渗出所致MIPI条索样间隔模式(图 17)。
![图片[21]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图17.jpg)
MIPI 不太常见于 TKI,但其影像学表现与细胞毒性药物相似。厄洛替尼和吉非替尼等 TKI 是表皮生长因子抑制剂,用于治疗非小细胞肺癌和其他一些实体恶性肿瘤。相关的MIPI,最常见的表现为弥漫性 GGO 或纤维化模式,仅发生在1%–2% 的患者中,但死亡率超过 30%。患有间质性肺病(ILD) 的患者特别容易发生 TKI 相关的纤维化 MIPI。病例报告还记录了与 TKI 相关的弥漫性肺泡出血。
靶向单克隆抗体曲妥珠单抗可表现为具有弥漫性 MIPI。该药物通常用于治疗 HER2 过表达的乳腺癌。据报道,曲妥珠单抗诱导的 MIPI 会在治疗开始后数周至数月引起弥漫性 GGO 和 OP 的 CT 模式 (图 18 )。
![图片[22]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图18.jpg)
免疫检查点抑制剂如 nivolumab、pembrolizumab、atezolizumab 和 ipilimumab 正被用于治疗越来越多的恶性肿瘤。
检查点抑制剂相关 MIPI 最常表现为 OP 模式,其次是纤维化 (NSIP) 和小叶中心 GGN 模式。NSIP 的发生频率可能与 OP 的患病率以及观察到一些初始组织病理学显示为 OP 的肺损伤在发生纤维化时演变为 NSIP 相关(图19、20)。毫不奇怪,考虑到 T 细胞活性的改变,这些药物也与结节病样改变有关。
当 CTLA-4抑制剂单独使用或与 PD-1 抑制剂联合使用时,这种模式的发生率可能会增加。
![图片[23]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图19.jpg)
![图片[24]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图20.jpg)
图 20. 53 岁男性皮肤鳞状细胞癌患者接受 Cemiplimab 治疗后出现呼吸急促、咳嗽和 OP 模式 MIPI 影像学表现,Cemiplimab 诱导的 MIPI。(A)初始 CT 的轴位图像显示右肺双侧支气管周围实变和圆形 GGO 病灶(箭头)。(B)停止cemiplimab 治疗和开始皮质类固醇治疗 2 个月后的轴向 CT 图像显示左肺改善,右上叶支气管周围实变恶化。(C)几个月后的轴向 CT 图像显示实变减少,残留 GGO 和不规则扩张的支气管(箭头),提示残留纤维化
住院患者
住院患者许多疾病都有可能接触抗生素或血液制品(表 2)。由抗生素引起的 MIPI 的发生率低于许多其他类别的药物,但由于大约 50% 的所有住院患者接受一种或多种抗生素,因此偶尔会遇到抗生素引起的 MIPI。血液成分的使用不如抗生素常见,但有 5%–10% 的住院患者接受血液制品治疗。
对出现肺部症状的住院患者考虑感染、误吸、静脉血栓栓塞和心源性肺水肿。在使用呋喃妥因等特定抗生素的情况下,对 MIPI 的怀疑会增加。呋喃妥因最常与表现为慢性症状的纤维化 MIPI 模式相关。达托霉素用于治疗革兰氏阳性细菌感染,其毒性作用更可能出现在急性至亚急性护理环境中。患者在开始用药后 2-4 周内出现发热、呼吸困难、肺部混浊和(通常)外周嗜酸性粒细胞增多。支气管肺泡灌洗液通常显示明显的嗜酸性粒细胞增多,活检显示慢性嗜酸性粒细胞性肺炎 (CEP)。
![图片[25]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图21.jpg)
CT 通常显示外周实变、GGO 和结节,这种外观可以符合 OP 模式。一般来说,外周带状斑片影和上叶优势在 CEP 中可能比在 OP 中更常见,但实际上 CEP 和OP 在成像时通常无法区分。事实上,OP 经常出现在 CEP 的活检标本中(图 22)。CEP不同于嗜酸性粒细胞增多的药物反应和全身症状(DRESS),DRESS 的特点是发热、皮疹、淋巴结肿大和内脏器官受累。在这些器官中,肾脏和肝脏比肺更常见。
![图片[26]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/图22.jpg)
接受输血的患者可能会出现输血相关肺损伤 (TRALI),表现为在输血期间或输血后 6 小时内出现无法解释的急性缺氧和肺部斑片影。CT 最初可能显示小叶间隔增厚,与线性间隔模式一致。在严重的情况下,斑片影可以迅速发展为弥漫性 GGO 模式,最终在大约 1 周内消退。
结论
MIPI 的出现频率越来越高,但其诊断通常很困难。放射科医生可以通过了解与 MIPI 相关的 CT 模式范围来提供帮助。了解哪些药物通常用于特定的临床情况以及熟悉由这些药物引起的最常见的 MIPI 成像模式可以加强放射科医生对诊断的贡献。
序贯成像结果与药物治疗过程的时间相关性在治疗前存在的肺部疾病中尤其重要,例如在患有结缔组织病或先前接受放射治疗的患者中。如果成像模式和疾病的时间发病都符合 MIPI,那么明确的诊断可能仍然具有挑战性。由于支气管肺泡灌洗结果甚至活检结果通常是非特异性的,因此最终诊断通常依赖于多学科意见。
(机翻+人工校正,错误请指正)
(![图片[27]-药物相关性肺损伤,这篇综述就够了! | 每周呼吸-每周呼吸](https://www.breathweekly.cn/wp-content/uploads/2022/03/扫码_搜索联合传播样式-标准色版.png) ,公众号回复“药物相关”可获取原文)
,公众号回复“药物相关”可获取原文)
[download id="2268"]






暂无评论内容